某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是()。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为()。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是()。
(4)丙组同学取10ml0.1mol•L-1KI溶液,加入6mL0.1mol•L-1FeCl3溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是()(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有(填离子符号),由此可以证明该氧化还原反应为()。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为();一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是(),生成沉淀的原因是()(用平衡移动原理解释)。
参考答案:
(1)防止Fe2+被氧化
(2)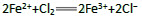
(3)隔绝空气(排除氧气对实验的影响)
(4)Fe2+;Fe3+可逆反应
(5) ;Fe3+催化氧化H2O2分解产生O2
;Fe3+催化氧化H2O2分解产生O2
H2O2分解反应放热,促进Fe3+的水解平衡正向移动
