(6分)实验室有4%的氢氧化钠溶液200g,并用此溶液测定某盐酸溶液的溶质质量分数。
(1) 恰好完全反应时,消耗4%的氢氧化钠溶液20g和25g某质量分数盐酸溶液,试计算该盐酸溶液中溶质的质量分数为多少?
(2)用配得的氢氧化钠溶液与待测溶质质量分数的盐酸溶液反应,实验过程中溶液的pH变化曲线如图所示,那么a点对应的溶液中,在单位体积中微粒数目最多的是 (填写化学符号)。
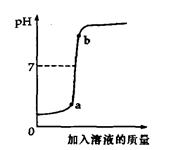
(3)将b点对应的溶液放在蒸发皿中慢慢地蒸干,所得的固体中除了NaCl外,还可能含有__ ____ _(写化学式)
(1)2.92% (2)H2O (3) NaOH Na2CO3
题目分析:(1)根据反应:NaOH+HCl==NaCl+H2O中NaOH与HCl的质量关系,可求出HCl的质量,进而可计算该盐酸溶液中溶质的质量分数
解:设HCl的质量为x
NaOH+HCl==NaCl+H2O
40 36.5
4%×20g x
40:36.5=4%×20g:x
x=0.73g
所以该盐酸溶液中溶质的质量分数=0.73g/25g×100%=2.92%
(2) 溶液包括溶质和溶剂,a点对应的溶液中,在单位体积中微粒数目最多的是H2O
(3)b点对应的溶液PH大于7,说明NaOH过量,因为是在蒸发皿中慢慢地蒸干,NaOH变质生成了部分Na2CO3,故所得的固体中除了NaCl外,还可能含有NaOH、Na2CO3

 而言,在小样本统计下(样本数据组n()时),置信水平为100(1-a)%的预测区间为。
而言,在小样本统计下(样本数据组n()时),置信水平为100(1-a)%的预测区间为。