酸雨是指pH<5.6的雨、雪等各种形式的大气降水.二氧化硫是形成酸雨的主要因素之一,它主要是由含硫燃料(煤和石油)燃烧和金属冶炼厂释放的二氧化硫气体造成.酸雨的危害极大,减少二氧化硫等污染物的排放,保护环境是非常重要的.某校化学兴趣小组的学生,分成两组对酸雨及空气中二氧化硫的含量进行了测定.
第一组,取刚降到地面的酸雨水样,进行了如下实验:
(1)将一片红色的玫瑰花瓣浸在一份水样中
(2)每隔一定时间测定其pH,数据如表Ⅰ所示.
(3)向雨水试样中滴加氯化钡溶液,有白色浑浊出现
表Ⅰ不同时间酸雨的pH
| 测定时间/小时钟 | 0 | 1 | 2 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
(2)生成白色浑浊的化学方程式______.
(3)分析上述pH数据变化,你认为可能的原因是(用化学方程式表示):______.
第二组,用拟用下列装置定量分析空气中SO2的含量:
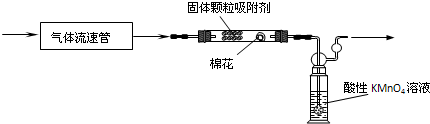
(4)该组同学查资料得到的反应原理为:SO2与酸性KMnO4溶液反应的化学方程式:5SO2+2KMnO4+2H2O=2H2SO4+2MnSO4+K2SO4.
该反应的现象是______
(5)KMnO4溶液中导管末端做成球状多孔结构的作用是______.
(6)该实验中已经知道的数据有气体流速aL/min、酸性KMnO4溶液的体积bL,其浓度为cmol/L.若从气体通入到紫色恰好褪去,用时5分钟.则此次取样处的空气中二氧化硫含量为______g/L.
(1)酸雨中含有SO2,SO2具有漂白性使玫瑰花红色变浅.
故答案为:酸雨中SO2具有漂白作用.
(2)硫酸与氯化钡反应生成硫酸钡和盐酸,反应方程式为BaCl2+H2SO4═BaSO4↓+2HCl.
故答案为:BaCl2+H2SO4═BaSO4↓+2HCl.
(3)二氧化硫溶于水生成亚硫酸,反应方程式为SO2+H2O=H2SO3,亚硫酸易被氧气氧化为硫酸,
反应方程式2H2SO3+O2=2H2SO4.
故答案为:SO2+H2O=H2SO3、2H2SO3+O2=2H2SO4.
(4)高锰酸钾溶液为紫色,KMnO4发生反应,溶液紫色褪去.
故答案为:高锰酸钾溶液紫色褪去.
(5)KMnO4溶液中导管末端做成球状多孔结构可以增大气体与溶液的接触,使气体充分被吸收.
故答案为:增大气体与溶液的接触,使气体充分被吸收.
(6)通入空气体积aL/min×5min=5aL,KMnO4物质的量为bL×cmol/L=bcmol,
5SO2+2KMnO4+2H2O=2H2SO4+2MnSO4+K2SO4
5 2
n(SO2)bcmol
所以 n(SO2)=
bcmol,质量为 5 2
bcmol×64g/mol=160bcg,5 2
此次取样处的空气中二氧化硫含量为
=160bcg 5aL
g/L.32bc a
故答案为:
.32bc a
