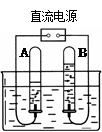
(6分)(1)右图是电解水的装置,通电一段时间后,B试管中收集到的气体是___________。此实验说明水是由______________元素组成。
(2)节约用水和合理开发利用水资源是每个公民应尽的责任和义务,你认为下列做法与之不相符的是_____________。
A.洗菜、洗衣、淘米的水用来浇花、拖地、冲厕所
B.免费使用昆玉河中的水洗车
C.合理施用农药、化肥,以减少水体污染
D.加强工业废水的排放监控,坚持达标排放(3)按下列要求各写一个有水生成的化学方程式,并注名反应条件。
①化合反应____________;②分解反应_____________;③复分解反应____________;
(1)氧气(或O2) 氢元素和氧元素 (2)B
(3)①2H2+O2 2H2O;②2H2O2 MnO22H2O+ O2③HCl + NaOH ="=" NaCl +H2O
2H2O;②2H2O2 MnO22H2O+ O2③HCl + NaOH ="=" NaCl +H2O
题目分析:(1)因为电解水时,正极产生氧气,负极产生氢气,且产生的氧气和氢气的体积比为1:2,而由图可知A、B两试管中的气体体积比为2:1,故可判定B试管中是氧气,A试管中是氢气;因为化学反应前后元素的种类不变,而反应生成的氢气是由氢元素组成的,氧气是由氧元素组成的,由此可知,水是由氢元素和氧元素组成的。
(2)节水的措施很多,但要注意保护水资源才是最重要的节水措施;根据水体污染的来源主要有工业污染、农业污染和生活污染可以排除C、D,A中的水属于一水多用,是节约用水的表现,而B中免费使用昆玉河中的水,会造成水的浪费,不利于水的节约利用,故选B。
(3)回顾所学的化学知识,结合化学反应的基本反应类型和有水生成的条件,写出三个化学方程式,①氢气在氧气中的燃烧生成水,故2H2+O2 2H2O;②过氧化氢或碳酸的分解,都有水的生成,如2H2O2 MnO22H2O+ O2;③所有酸碱中和反应都有水的生成,如HCl+NaOH ="NaCl" +H2O
2H2O;②过氧化氢或碳酸的分解,都有水的生成,如2H2O2 MnO22H2O+ O2;③所有酸碱中和反应都有水的生成,如HCl+NaOH ="NaCl" +H2O
点评:解答本题的关键是,熟练掌握电解水实验的现象及结论,明确的知道水体污染的来源及节约用水的措施和做法。

