硫酸亚铁铵的化学式为(NH4)2SO4•FeSO4•6H2O,商品名为莫尔盐,可由硫酸亚铁与硫酸铵反应生成.一般硫酸亚铁盐在空气中易被氧化,而形成莫尔盐后就比较稳定了.三种盐的溶解度(单位为g/100g水)如下表:
| 温度/℃ | 10 | 20 | 30 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 |
| FeSO4•7H2O | 20.0 | 26.5 | 32.9 |
| (NH4)2SO4•FeSO4 | 17.2 | 21.6 | 28.1 |
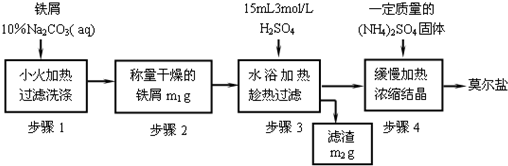
试回答下列问题:
(1)步骤1中加入10% Na2CO3溶液的主要作用是______;反应中铁屑过量是为了______.
(2)步骤3需要趁热过滤,原因是______.
(3)从步骤4到莫尔盐,必须进行的操作依次是______,析出的晶体常用______洗涤.
(4)若莫尔盐的饱和溶液中有水20克,当温度从30℃降至10℃,最多析出莫尔盐的质量是______(选填编号).
A.2.18g B.大于2.18g C.小于 2.18g D.无法确定
(二)称取质量为1.96g的莫尔盐制成溶液.用未知浓度的酸性KMnO4溶液进行滴定.
(1)已知MnO4-被还原为Mn2+,试写出该滴定反应的离子方程式______.
(2)判断该反应到达滴定终点的现象为______.
(3)假设到达滴定终点时,用去VmL酸性KMnO4溶液,则该酸性KMnO4溶液的浓度为______mol/L.
(一)(1)碳酸钠水解显酸性,油脂在碱性条件下能水解;还原氧化生成的Fe3+,减少产物中的Fe3+杂质,
故答案为:除铁屑表面的油污;还原氧化生成的Fe3+,保证Fe2+稳定、纯净地存在,减少产物中的Fe3+杂质;
(2)如果不趁热过滤就会有FeSO4•7H2O析出,故答案为:FeSO4在温度低时溶解度较小,如果不趁热过滤就会有FeSO4•7H2O析出;
(3)浓缩结晶后需要过滤、洗涤;硫酸亚铁铵在无水乙醇何总的溶解度小;温度低时,硫酸亚铁铵的溶解度小,可用冰水洗涤,故答案为:过滤、洗涤;无水酒精或冰水;
(4)(NH4)2SO4•FeSO4在30度和10度的溶解度分别为:28.1和17.2g,即若溶剂为100g水,冷却析出10.9g,有水20克析出2.18g,硫酸亚铁铵的化学式为(NH4)2SO4•FeSO4•6H2O含有结晶水,故析出质量大于2.18g,故答案为:B;
(二)(1)反应的离子方程式5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O;
(2)高锰酸钾本身有颜色,滴定亚铁离子不需要指示剂,当滴加最后一滴溶液后,溶液变成紫红色,30S内不褪色,说明达到滴定终点,故答案为:加入最后一滴KMnO4溶液紫红色不褪,且半分钟内不褪色;
(3)1.96g硫酸亚铁铵晶体的物质的量n=
=m M
=0.005mol,根据原子守恒则亚铁离子的物质的量为0.005mol,反应5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,则5Fe2+~MnO4-,所以高锰酸钾的物质的量为0.001mol,据c=1.96g 392g/mol
=n V
=0.001mol 10 -3VL
mol/l,故答案为:1 V
.1 V
