问题
填空题
某校课外活动小组的同学们利用水的电解实验探究水的组成,他们量取192.7mL水(水的密度为1.00g/cm3),并向水中加入了7.3g氢氧化钠固体,充分溶解后按下图所示的装置进行实验,接通电源,当A管收集到22.3mL气体(气体密度为0.09g/L)时,停止实验。请分析回答:
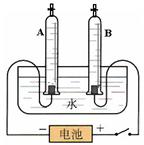
(1)水通电分解的化学反应方程式为:
(2)实验中A管生成的气体质量是 ;
(3)向水中加入氢氧化钠固体的目的是
;
(4)停止实验时剩余“水中”氢氧化钠的质量分数是多少?(列式计算)
答案
(1)2H 2O  2H2↑+O2↑
2H2↑+O2↑
(2)22.3mL×0.09g/L×10-3=0.002g
(3)增强“水”的导电性
(4)  ×100%=3.65% (2分)
×100%=3.65% (2分)
(1)电解水的化学方程式为2H 2O  2H2↑+O2↑;(2)m=ρV=22.3mL×0.09g/L×10-3="0.002g;" (3)纯净的水是不导电的,加入NaOH固体目的就是增强“水”的导电性;(4)电解产生0.002gH2需要水的质量为 0.002g ×9=0.018g,则反应后溶液的质量=192.7mL×1.00g/cm3+7.3g-0.018g=199.982g,则NaOH的质量分数为
2H2↑+O2↑;(2)m=ρV=22.3mL×0.09g/L×10-3="0.002g;" (3)纯净的水是不导电的,加入NaOH固体目的就是增强“水”的导电性;(4)电解产生0.002gH2需要水的质量为 0.002g ×9=0.018g,则反应后溶液的质量=192.7mL×1.00g/cm3+7.3g-0.018g=199.982g,则NaOH的质量分数为
7.3g/199.982g×100%="3.65%" 。
