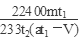(18分)含硫物质燃烧会产生大量烟气,主要成分是SO2、CO2、N2、O2。某研究性学习小组在实验室利用下列装置制备模拟烟气,并测算模拟烟气通过转化器的脱硫效率。
回答下列问题:
I.模拟烟气的制备
(1)用A装置制SO2,其化学反应方程式为 。
(2)用B装置制CO2,使用该装置优点的是 。
(3)将制得的气体与空气充分混合,获得模拟烟气用于后续实验。
II.测定烟气中SO2的体积分数
(4)将部分模拟烟气缓慢通过C、D装置,其中C、D中盛有的药品分别是 、 。(填序号)
①KMnO4溶液 ②饱和NaHSO3溶液 ③饱和Na2CO3溶液 ④饱和NaHCO3溶液
(5)若模拟烟气的流速为a mL/min,若t1分钟后,测得量简内液体体积为V mL(已折算为标准状况),则SO2的体积分数是 。
III.测算模拟烟气通过转化器的脱硫效率(已转化的SO2占原有SO2的百分比)
(6)将模拟烟气通过转化器E装置,E装置中盛有FeCl2、FeCl3的混合溶液,常温下,它可催化SO2与O2的反应,以达到脱硫目的。写出SO2与FeCl3溶液参与反应过程的离子方程式 。
(7)若模拟烟气仍以a mL/min的流速通过转化器E装置,t2分钟后,向E装置中加入酸化的BaCl2溶液得到白色浑浊液,经 、洗涤、 、称量,得到mg固体。若实验的气体体积已折算为标准状况,则该转化器的脱硫效率是 。
I.(1)Cu + 2H2SO4(浓) CuSO4 + 2H2O + SO2↑(2分)
CuSO4 + 2H2O + SO2↑(2分)
(2)可以随时控制反应的发生和停止(2分)
Ⅱ.(4)① ④(各1分,共2分) (5)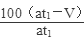 % (3分)
% (3分)
(6)2H2O + 2Fe3+ + SO2 =2Fe2+ + SO42- + 4H+ (2分)
(7)过滤 (2分) 干燥 (2分) 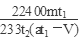 (3分)
(3分)
题目分析:(1)装置A需要加热,这说明所用试剂是浓硫酸和铜,反应的化学方程式为Cu + 2H2SO4(浓) CuSO4 + 2H2O + SO2↑。
CuSO4 + 2H2O + SO2↑。
(2)B装置制CO2,属于简易启普发生器,使用该装置优点的是通过控制长颈漏斗盐酸的加入量,控制反应的发生和停止。
Ⅱ.(4)二氧化硫具有强的还原性,可以用强氧化性的高锰酸钾吸收;二氧化碳在饱和碳酸钠溶液中的溶解度很小,可以用排饱和碳酸氢钠溶液来侧量其体积,故答案为:①④;
(5)二氧化碳的体积是Vml,则二氧化碳的体积分数为: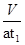 ,则二氧化硫的体积分数为100%-
,则二氧化硫的体积分数为100%-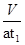 =
=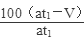 %;
%;
(6)①SO2+2H2O+2Fe3+═SO42-+2Fe2++4H+在反应①中三价铁离子被还原为二价铁离子,要想保持质量、性质不变,得到的二价铁离子应该被氧气氧化为三价铁离子,反应的方程式为:4Fe2++O2+4H+=2H2O+4Fe3+;
(7)为了保证准确的测量出反应生成的硫酸钡固体,从溶液中分离固体硫酸钡,依次进行过滤、洗涤、干燥的操作;t2分钟内烟气中含二氧化硫的体积为:V(SO2)=at2×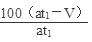 %;根据上述反应可知各物质之间量的关系为:
%;根据上述反应可知各物质之间量的关系为:
SO2~SO42-~BaSO4
22400ml 233g
V(SO2)′ mg
所以转化的二氧化硫气体的体积为:V(SO2)′=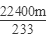
则二氧化硫的转化率=