(10分)Ⅰ中国有广阔的海岸线,海水的综合利用大有可为,海水中溴含量约为65mg/L,从海水中提取Br2的工艺流程如下:
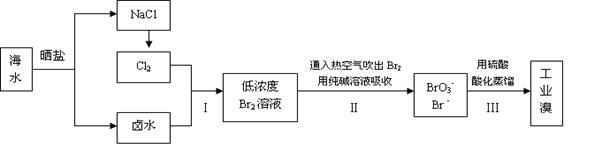
(1) 步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的 ;
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(2) 请写出步骤Ⅱ中反应的离子反应方程式 ;
(3) 实验室分离溴水中的溴还可以用萃取法,下列可以用作萃取剂的是 ;
A.乙醇 B.四氯化碳 C.烧碱溶液 D.苯
Ⅱ (1)目前世界上60%的镁单质是从海水中提取的。以下是海水中提炼金属镁的简易流程图(结合工业生产实际,在括号内填写需要加入物质的化学式,方框内填写生成物质的化学式)

(2)海带中含有碘离子,常用过氧化氢、稀硫酸和淀粉来检验其阴离子,其主要反应的离子方程式为 。
Ⅰ(1)C (2)3Br2+3CO32-====BrO3-+5Br-+3CO2↑ (3)BD
Ⅱ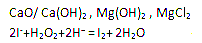
题目分析:I(1)利用热空气将溴吹出,不涉及化学反应,故应用的物理性质挥发性;(2)根据图示信息可得溴和碳酸钠反应生成了溴酸根离子和溴离子,根据原子守恒及反应原理分析还生成二氧化碳;(3)萃取剂必须满足的条件是与原溶剂不互溶,故排除AC,选BD;II(1)将镁离子转化为氢氧化镁,使镁富集,故需加入沉淀剂氧化钙,或氢氧化钙等;(2)酸性条件下碘离子被双氧水氧化为碘单质,淀粉检验碘单质的存在。
