下列反应中,最适用于实验室制备CO的是[ ]
A.焦炭和氧气反应:2C+O2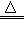 2CO
2CO
B.草酸和浓硫酸共热:H2C2O4 CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
C.二氧化硫与炙热的碳反应:CO2+C 2CO
2CO
D.甲酸和浓硫酸共热:HCOOH CO↑+H2O
CO↑+H2O
答案:D
下列反应中,最适用于实验室制备CO的是[ ]
A.焦炭和氧气反应:2C+O2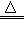 2CO
2CO
B.草酸和浓硫酸共热:H2C2O4 CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
C.二氧化硫与炙热的碳反应:CO2+C 2CO
2CO
D.甲酸和浓硫酸共热:HCOOH CO↑+H2O
CO↑+H2O
答案:D