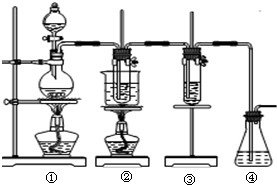
在实验室里可用右图所示装置制取氯酸钾和探究氯水的性质. 图中:①为氯气发生装置;②的试管里盛有15mL 30%KOH溶液,并置于水浴中;③的试管里加有紫色石蕊试液;④为尾气吸收装置.请填写下列空白:
(1)制取氯气时,先在烧瓶里加入一定量的二氧化锰,再通过______(填写仪器名称)向烧瓶中加入适量的浓盐酸.实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有______(填写下列编号字母)的净化装置.A.碱石灰B.饱和食盐水C.浓硫酸
(2)如果将过量二氧化锰与20mL 12mol•L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol.其主要原因有:①______,②______.
(3)反应完毕经冷却后,②的试管中有大量晶体析出.

图中符合该晶体溶解度曲线的是______(填写编
号字母);从②的试管中分离出该晶体的方法是______(填写实验操作名称).
(4)实验中可观察到③的试管里溶液的颜色发生了如下变化,请填写下表中的空白.
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为______色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | ______ |
| 然后溶液从无色逐渐变为______色 | ______ |
(1)向烧瓶中加入浓盐酸应该使用分液漏斗.制取氯气时需要加热,会使浓盐酸挥发出来,因此除去HCl,可以使用饱和食盐水,既除去HCl又降低氯气在水中的溶解度,即选用B.故答案为:分液漏斗;B;
(2)浓盐酸中含有HCl:0.2L×12mol/L═2.4mol,根据化学方程式:MnO2+4HCl=MnCl2+Cl2+2H2O可知:在二氧化锰过量的条件下,如果HCl完全反应,会生成氯气0.6mol,但是浓盐酸与二氧化锰反应成为稀盐酸后将不会反应生成氯气,即生成的氯气会小于0.6mol,更何况本实验需要加热,浓盐酸会挥发出来,因此答案为:①盐酸挥发;②反应一段时间后,盐酸变稀,无法被MnO2氧化.故答案为:盐酸挥发;反应一段时间后,盐酸变稀,无法被MnO2氧化;
(3)根据题意,本题要制取氯酸钾,说明装置②是在加热的条件下氯气与氢氧化钾溶液反应,即3Cl2+6KOH=5KCl+KClO3+3H2O,析出的必然是氯酸钾.氯酸钾能从溶液中析出,说明它的溶解度受温度的影响比较大,即温度越高溶解度越大,观察图中曲线符合题目条件的只有M(P受温度影响较小).从溶液中分离出氯酸钾晶体,只能使用过滤的方法.
故答案为:M;过滤;
(4)氯气通入紫色石蕊试液,由于氯气与水反应,即Cl2+H2O=Cl-+H++HClO,由于氯水显酸性,则氯水能使紫色石蕊试液变成红色,而后由于氯水中存在次氯酸,次氯酸具有漂白性,可以使红色石蕊试液退成无色,此后,由于氯气继续通入溶液,通入的氯气不再继续表现氧化性,而是要溶解在水中,最终形成氯水,其颜色呈现黄绿色或浅黄绿色.
故答案为:
| 实验现象 | 原因 |
| 红 | |
| 氯气与水反应生成HClO具有漂白性 | |
| 浅黄绿 | 过量氯气溶解于水中 |
