氯是重要的非金属元素。
30.NaCl和浓硫酸微热制取氯化氢的化学方程式为 ;
可用 试纸放在瓶口以检验氯化氢气体是否集满。
31.新制氯水中含有的分子有:Cl2、H2O和 ;光照新制氯水的化学方程式为 ;工业是用电解食盐水制取氯气,阴极的电极反应式为:
2H++2e→H2↑,则阳极的电极反应式为 。
32.已知还原性SO32->I->Br-.向NaBr、NaI、Na2SO3混合溶液中,通入—定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是______(选填编号)。
a. NaCl Na2SO4 b. NaCl NaBr Na2SO4
c. NaCl Na2SO4 I2 d. NaCl NaI Na2SO4
30.NaCl+ H2SO4 (浓)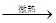 NaHSO4+HCl↑(2分);湿的蓝色石蕊试纸(或湿的pH试纸)(1分)。
NaHSO4+HCl↑(2分);湿的蓝色石蕊试纸(或湿的pH试纸)(1分)。
31.HClO(1分); 2 HClO 2HCl+O2↑(1分); 2Cl--2e→Cl2↑(1分)
2HCl+O2↑(1分); 2Cl--2e→Cl2↑(1分)
32.ab(2分)
题目分析:30.NaCl和浓硫酸微热制取氯化氢时生成NaHSO4;氯化氢气体为酸性气体,可用湿润的紫色石蕊试纸等放在瓶口以检验氯化氢气体是否集满。
31.新制氯水中含有的分子有:Cl2、H2O和HClO;光照新制氯水,氯水中的HClO分解为HCl和O2;工业是用电解食盐水制取氯气,阴极是阳离子H+放电生成H2,2H++2e→H2↑,阳极是阴离子Cl-放电生成Cl2。
32.已知还原性SO32->I->Br-.向NaBr、NaI、Na2SO3混合溶液中,通入—定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是
极少Cl2:只有Na2SO3部分反应,产物NaCl、NaBr、NaI、Na2SO4(由Na2SO3在空气中氧化),b正确。;
适量Cl2:有NaI、Na2SO3反应,产物NaCl、NaBr、Na2SO4;
过量Cl2:NaBr、NaI、Na2SO3全分反应,产物NaCl、Na2SO4,a正确 。
