(12分) 实验室中以铝土矿(主要成分是Al2O3和少量的SiO2和Fe2O3杂质)为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如下:
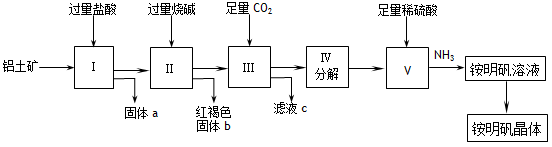
试回答下列问题:
⑴固体a的化学式为_____,III中通入过量CO2气体的离子方程式为 。
⑵由V制取铵明矾溶液的化学方程式为__________________________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称) 、冷却结晶、过滤洗涤。
⑶以1000kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数98%的硫酸(密度1.84g/cm3)___________L(保留一位小数)。
⑷若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中Al2O3和H2SO4的物质的量之比为___________。
(12分)
⑴SiO2(2分) AlO2-+CO2+2H2O ==HCO3-+Al(OH)3↓(2分)
⑵Al2(SO4)3 + H2SO4 + 2NH3 ==2NH4Al(SO4)2(2分) 蒸发浓缩(2分)
⑶575.4L(2分) ⑷3:10(2分)
铝土矿中含有Al2O3、SiO2和Fe2O3,当加入过量的盐酸时,SiO2是酸性氧化物不与盐酸反应,而Al2O3为两性氧化物,与过量的盐酸反应生成ALCL3;Fe2O3为碱性氧化物,与过量的盐酸反应生成FeCL3,所以,反应后经过滤得到的固体a为SiO2固体;再向滤液中加入过量的氢氧化钠溶液时,FeCL3与氢氧化钠反应生成氢氧化铁红褐色沉淀,而ALCL3则与过量的氢氧化钠溶液反应生成偏铝酸钠溶液;再过滤后得到的固体b为氢氧化铁溶液,再向滤液中通入足量的CO2气体时,偏铝酸钠会与CO2反应生成氢氧化铝沉淀,氢氧化铝不稳定,加热分解成氧化铝,向氧化铝中加入足量的硫酸会生成硫酸铝溶液,再通入足量的氨气,则生成铵明矾溶液,再经蒸发浓缩、冷却结晶即可得晶体。
所以:
⑴SiO2 AlO2-+CO2+2H2O ==HCO3-+Al(OH)3↓
⑵Al2(SO4)3 + H2SO4 + 2NH3 ==2NH4Al(SO4)2 蒸发浓缩
(3)1000kg含氧化铝36%的铝土矿中氧化铝的质量=360kg,即氧化铝的物质的量=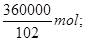 在Al2(SO4)3的化学式中分析可得,硫酸根离子与铝离子的物质的量之比=3:2,进而可求得需消耗质量分数98%的硫酸575.4L。
在Al2(SO4)3的化学式中分析可得,硫酸根离子与铝离子的物质的量之比=3:2,进而可求得需消耗质量分数98%的硫酸575.4L。
