水是生命之源,是自然界中重要的物质.
Ⅰ.温泉的利用是人们开发地热的一种形式,南京汤山温泉具有悠久的文化.
(1)清澈的温泉水是______(填“纯净物”或“混合物”).
(2)净化温泉水的过程中,会使用到活性炭,主要是利用其______作用.
(3)鉴别温泉水是硬水还是软水需加入的试剂是______.
Ⅱ.海水是巨大的资源宝库.海水晾晒可得到粗盐,已知某粗盐样品中除泥沙外还含有Na2SO4、MgCl2、CaCl2等杂质.实验室提纯流程如下: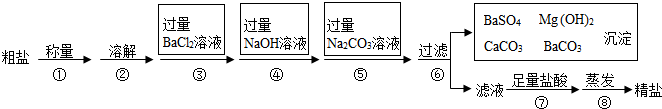
(1)用托盘天平称量10.2g粗盐样品时,若指针偏向左边,则表示(填字母序号)______.
A.右盘重,砝码轻B.右盘轻,样品少
C.左盘重,样品多D.左盘轻,砝码重
(2)第④步操作发生反应的化学方程式是______.
(3)第⑤步操作的目的是______.
(4)在第⑦步操作中,向滤液中滴加足量盐酸的目的是______.
Ⅲ.水也是一种重要的原料.某工厂用电解水的方法来制取氧气,若制取100kg氧气,理论上消耗水的质量是多少?(写出计算过程)______.
Ⅰ(1)清澈的温泉水中仍然含有一些溶于水的物质,属于混合物.
(2)活性炭具有吸附性,能吸附色素和异味.故净化温泉水的过程中,活性炭可以吸附水中的色素和异味,从而达到净化水的目的.
(3)区分硬水和软水的方法是:取适量样品倒入烧杯中,向烧杯中滴入适量肥皂水搅拌,若有大量泡沫出现,则为软水;若出现大量浮渣,则为硬水.
Ⅱ(1)称量物质是“左物右码”,所以用托盘天平称量粗盐时,若指针偏向左边,则表示左盘重,样品多;
(2)加入过量氢氧化钠溶液的目的是除去氯化镁,发生反应的化学方程式是MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
(3)加入过量的碳酸钠溶液的目的除去杂质CaCl2和加入的过量试剂BaCl2;
(4)在第⑦步操作中,向滤液中滴加足量盐酸的目的是除去加入的过量试剂NaOH和Na2CO3;
Ⅲ、根据化学方程式,已知量为氢气,求未知量水.
故答案为:Ⅰ.(1)混合物(2)吸附(3)肥皂水
Ⅱ.(1)C(2)2NaOH+MgCl2═Mg(OH)2↓+2NaCl
(3)除尽氯化钡和氯化钙(4)除去过量的NaOH和Na2CO3
Ⅲ.设:需要水的质量为x
2H2O
2H2↑+O2↑通电 .
3632
x100kg
=36 x 32 100kg
x=112.5kg
答:所需氯化钠溶液的质量是112.5kg
