铜是一种重要的金属元素,铜元素与银元素同处第ⅠB族,+1价的铜和+1价的银都可形成二配位的络离子,如Ag(NH3)2+、AgCl2-等,含铜最丰富的天然资源是黄铜矿(CuFeS2).
(1)从黄铜矿冶炼粗铜的传统工艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜.这种方法的缺点是、.
(2)现有一种湿法冶炼技术,以黄铜矿为主要原料来生产铜、铁红颜料和可用于橡胶硫化的硫单质,原料的综合利用率较高.其主要流程如下:
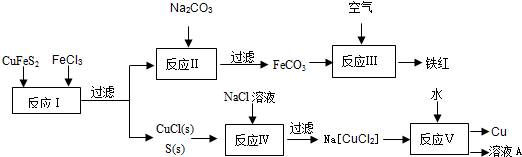
①写出反应Ⅰ中FeCl3与CuFeS2所发生反应的化学方程式:______;
②写出反应Ⅳ中发生反应的离子方程式:______.
③反应Ⅲ是FeCO3在空气中煅烧,写出化学方程式:______.
④反应Ⅴ所得溶液A中含有的溶质有______.
(1)富铜矿砂与空气在高温下煅烧,使其转变为铜,反应产物有污染性气体二氧化硫生成,要消耗大量的热能,生成SO2会导致大气污染,故答案为:SO2会导致大气污染,同时要消耗大量的热能.
(2)①CuFeS2和3FeCl3之间发生的是氧化还原反应,化学方程式为:CuFeS2+3FeCl3=CuCl↓+4FeCl2+2S↓,故答案为:CuFeS2+3FeCl3=CuCl↓+4FeCl2+2S↓;
②结合CuCl和NaCl反应生成Na[CuCl2],反应实质为:Cl-+CuCl=[CuCl2]-,故答案为:Cl-+CuCl=[CuCl2]-;
③FeCO3在空气中煅烧会和氧气发生反应:4FeCO3+O2
4CO2+2Fe2O3,故答案为:4FeCO3+O2 高温 .
4CO2+2Fe2O3. 高温 .
④反应Ⅴ为Na[CuCl2]和H2O之间的反应,生成物是Cu、NaCl和CuCl2,所得的溶液中的溶质是CuCl2、NaCl,故答案为:CuCl2、NaCl;

 面窝的结构是()
面窝的结构是()