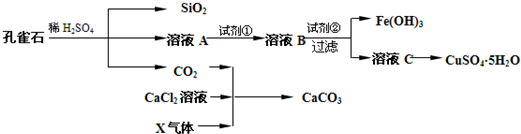
孔雀石主要成分Cu2(OH)2CO3,其中还含少量Fe、Si的化合物.实验室以孔雀石为原料制备CuSO4•5H2O及CaCO3的流程如下:
请回答下列问题:
(1)溶液A中含有的阳离子有______.实现由溶液A至溶液B转化的试剂①为______(填代号).
①.KMnO4 ②.(NH4)2S ③.O3 ④.浓硫酸 ⑤H2O2
(2)试剂②可以选用______(填代号)
A.Fe B.CuO C.Fe2O3 D.CuCO3 E.xCu(OH)2•yCuCO3 F.Cu(OH)2
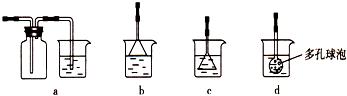
(3)由CaCl2溶液制备CaCO3时,通入的气体X是______(填化学式).若实验过程中有X气体逸出,可选用下列______装置回收(填代号).
(4)欲测定溶液A中还原性金属阳离子的浓度,需要取A溶液配制进行氧化还原滴定.若选用KMnO4标准溶液进行滴定时应选用______滴定管(填“酸式”或“碱式”).滴定反应的离子方程式______
(5)由溶液C制取晶体的实验操作是______.
(1)孔雀石主要成分Cu2(OH)2CO3,其中还含少量Fe、Si的化合物.铁元素主要以+2、+3价存在,孔雀石与硫酸反应中,硫酸过量,所以溶液A中含有的阳离子有Cu2+、Fe2+、Fe3+、H+等.
由工艺流程转化关系可知,实现由溶液A至溶液B转化,目的是将Fe2+氧化为Fe3+,试剂①应为氧化剂,且不能引入新的杂质.
①KMnO4可以将Fe2+氧化为Fe3+,但引入K+、Mn2+等杂质,故①错误;
②(NH4)2S不能将Fe2+氧化为Fe3+,故②错误;
③O3可以将Fe2+氧化为Fe3+,且不引入新杂质,故③正确;
④浓硫酸加入溶液中,浓度变稀,不能将Fe2+氧化为Fe3+,故④错误;
⑤H2O2可以将Fe2+氧化为Fe3+,且不引入新杂质,故⑤正确.
故选:③⑤.
(2)由工艺流程转化关系可知,试剂②应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,且不能引入新的杂质.
A.Fe与Fe3+反应,故A错误;
B.CuO中和H+,溶液pH增大,使Fe3+转化为Fe(OH)3,不引入杂质,故B正确;
C.Fe2O3中和H+,溶液pH增大,又引入Fe3+,故C错误;
D.CuCO3中和H+,溶液pH增大,使Fe3+转化为Fe(OH)3,不引入杂质,故D正确;
E.xCu(OH)2•yCuCO3 中和H+,溶液pH增大,使Fe3+转化为Fe(OH)3,不引入杂质,故E正确;
F.Cu(OH)2中和H+,溶液pH增大,使Fe3+转化为Fe(OH)3,不引入杂质,故F正确.
故选:BDEF.
(3)由工艺流程转化关系可知,加入X使溶液在碱性条件下反应,所以气体X应为碱性气体,故X为氨气.由于氨气极易溶于水,吸收应采取防倒吸装置(采取倒置漏斗或在吸收装置连接防倒吸安全瓶).
a、吸收装置前边连接防倒吸安全瓶,故a正确;
b、连接防倒吸的倒置漏斗,漏斗边缘紧贴液面,可以防止倒吸,故b正确;
c、连接的倒置漏斗,但漏斗全部在浸在液面下,不能起防止倒吸作用,故c错误;
d、多孔球全部在浸在液面下,不能起防止倒吸作用,故d错误.
故答案为:NH3;ab
(4)KMnO4溶液极易强氧化性,可以腐蚀碱式滴定管的橡皮管,使用KMnO4溶液时通常加酸,所以KMnO4溶液应放置酸式滴定管内.
溶液A中还原性金属阳离子为Fe2+,在酸性条件下,MnO4-+将Fe2+氧化为Fe3+,自身被还原为Mn2+,同时生成水.反应中Fe2+→Fe3+,铁元素化合价升高1价;MnO4-+→Mn2+,锰元素降低5价,化合价升降最小公倍数为5,故Fe2++系数为5,MnO4- 系数为1,根据元素守恒可知Mn2+与Fe3+系数分别为1、5,根据电荷守恒可知,H+其系数为2+3×5-[2×5-1]=8,根据H元素守恒可知H2O系数是4,所以反应离子方程式为5Fe2++1MnO4-+8H+=1Mn2++5Fe3++4H2O.
故答案为:酸式;5Fe2++1MnO4-+8H+=1Mn2++5Fe3++4H2O.
(5)由溶液到晶体需要加热蒸发、冷却结晶、过滤、洗涤、干燥等.
故答案为:加热蒸发、冷却结晶、过滤、洗涤、干燥.
