问题
问答题
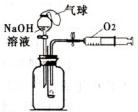
某化学研究小组在探究硫燃烧的实验时,设计了如如图所示的实验装置.
实验步骤为:①将燃烧匙内的硫点燃后,立即伸人盛有空气的集气瓶内,并塞紧橡皮塞,观察现象.②将分液漏斗的活塞打开,同时打开胶皮管上的弹簧夹,观察现象.请回答下列问题:
(1)将注射器内的氧气推人集气瓶内后,发现硫燃烧更加剧烈,这种现象说明燃烧的剧烈程度与什么因素有关?
(2)分液漏斗内的氢氧化钠溶液、漏斗口的气球的作用分别是什么?
(3)写出探究过程中所发生反应的化学方程式(写出一个即可).
答案
(1)可燃物的燃烧剧烈程度与氧气的浓度和可燃物本身的性质等有关.
(2)由分析可知:①氢氧化钠溶液的作用:吸收生成的二氧化硫气体;②气球的作用:防止二氧化硫逸散到空气中.
(3)根据反应物和生成物,以及质量守恒定律,正确书写化学方程式.
故答为(1)与氧气的浓度有关;
(2)吸收有害气体二氧化硫、防止二氧化硫逸散到空气中;
(3)S+O2
SO2,点燃 .
或2NaOH+SO2=Na2SO3+H2O
