(12分)某化学兴趣小组用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
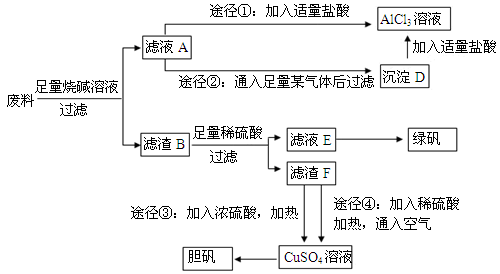
(1)写出合金与烧碱溶液反应的离子方程式: 。
(2)由滤液A制AlCl3溶液的途径有①和②两种,你认为较合理的途径及理由是: 。
(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了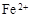 和
和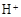 外,还可能存在 (用元素符号表示)。
外,还可能存在 (用元素符号表示)。
(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是:
、 。
(5)途径④发生反应的化学方程式为: 。
(6)实验室从CuSO4溶液制取胆矾,操作步骤有蒸发浓缩、冷却结晶、 、自然干燥。
(12分)
(1)2Al + 2OH + 2H2O = 2AlO2 + 3H2↑ (2分)
(2)②合理,途径②制得AlCl3溶液纯度高,①制取的AlCl3溶液中混有NaCl杂质(2分)
(3)Fe3+(2分)
(4)成本低;不产生有毒气体(合理给分)(各1分)
(5)2Cu+2H2SO4+O2===2CuSO4+2H2O(2分)
(6)过滤洗涤(2分)
题目分析:(1)由题可知,与烧碱反应的物质应在滤液中,滤液通过反应最终生成的产物是AlCl3,所以合金中与烧碱反应的物质应为铝。
(2)途径①中生成的NaCl很难出去,途径②通过沉淀再溶解的方式可得到纯度较高的AlCl3。
(3)由题滤液E中含有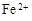 和
和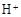 ,Fe2+在空气中暴露一段时间易被氧化为Fe3+
,Fe2+在空气中暴露一段时间易被氧化为Fe3+
(4)首先途径③使用浓硫酸发生氧化还原反应Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O;其次,浓硫酸的价格高于稀硫酸,会提高成本
(5)由题是Cu在稀硫酸的环境下与氧气发生氧化还原反应,其反应实质是碱性金属氧化物与酸的反应
(6)从溶液中提取溶质,操作步骤为蒸发浓缩、冷却结晶、过滤洗涤、自然干燥。
