(12分)铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(杂质中不含铁元素,且杂质不与H2、H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定
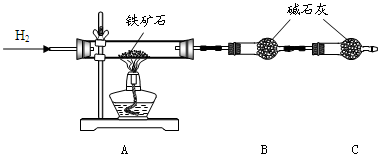
实验结果:将5.0g铁矿石放入硬质玻璃管中完全反应, 测得装置B增重1.35 g。
Ⅱ.铁矿石中含铁量的测定
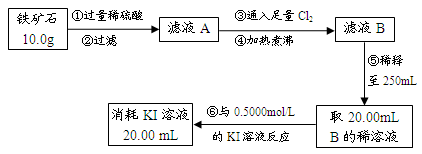
Ⅲ.问题讨论与解决:
(1)如要验证滤液A中铁元素的存在形式,可另取两份滤液A分别进行实验,实验方法、现象与结论如下表。请将其补充完整。
可供选择的试剂有:酸性KMnO4溶液、NaOH溶液、KSCN溶液、氯水
| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液A中加入 | 滤液A中有Fe3+ | |
| 步骤2:在滤液A中加入 | 滤液A中有Fe2+ |
(3)步骤③中反应的离子方程式为: ;
(4)请通过实验Ⅰ、Ⅱ计算出该铁矿石中铁的氧化物的化学式。(写出计算过程)
(1)
| 实验方法 | 实验现象 | 结论 |
| 加入 KSCN溶液 (1分) | 溶液呈血红色 | (1分) |
| 加入 酸性KMnO4溶液 (1分) | KMnO4溶液褪色 | (1分) |
(2)除去滤液A中过量的Cl2 (2分)
(3)2Fe2++Cl2 = 2Fe3++2 Cl- (2分)
(4)10g矿石中:n(O)=0.15mol (1分)
10g矿石中:n(Fe)= n(Fe3+) = 0.125mol (2分)
n(Fe):n(O)=" 0.125mol:" 0.15mol =5:6 即化学式为:Fe5O6 (1分)
题目分析:⑴根据供选试剂,用KSCN溶液检验滤液A中含有Fe3+(溶液呈血红色);用酸性KMnO4溶液检验滤液A中含有Fe2+(溶液褪色);
⑵加入足量氯气后加热煮沸,能将反应液中过量的氯气除去,防止与步骤⑥中KI反应给实验结果带来干扰;
⑶步骤③用氯气将Fe2+氧化为Fe3+;
⑷在10g矿石中:n(O)=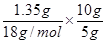 =0.15mol;
=0.15mol;
在10g矿石中:n(Fe)= n(Fe3+) =n(I-)=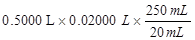 = 0.125mol;
= 0.125mol;
则n(Fe):n(O)= 0.125mol::0.15mol =5:6; 即化学式为:Fe5O6 。
