工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:

已知:Cu2O+2H+=Cu+Cu2++H2O
(1)实验操作Ⅰ的名称为________;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有________(填仪器名称)。
(2)滤液A中铁元素的存在形式为________(填离子符号),生成该离子的离子方程式为____________________________________________,检验滤液A中存在该离子的试剂为________(填试剂名称)。
(3)金属单质E与固体混合物F发生的某一反应可用于焊接钢轨,该反应的化学方程式为__________________________________________________。
(4)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍。则两种溶液的pH=________。
(5)从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗铜样品中金属铜的质量分数,涉及的主要步骤:称取一定质量的样品→________________→过滤、洗涤、干燥→称量剩余固体铜的质量。(填缺少的操作步骤,不必描述操作过程的细节)
(1)过滤 坩埚
(2)Fe2+ 2Fe3++Cu=2Fe2++Cu2+ 硫氰化钾溶液和新制氯水(合理的氧化剂均可)
(3)2Al+Fe2O3 Al2O3+2Fe (4)11
Al2O3+2Fe (4)11
(5)将浓硫酸用蒸馏水稀释,将称得的样品与足量稀硫酸充分反应
由流程图可以看出,加入足量稀盐酸时,得到的固体混合物B为二氧化硅和单质铜,则滤液A中一定不含Fe3+,原因是2Fe3++Cu=2Fe2++Cu2+,验证Fe2+可先加入KSCN溶液,没有明显现象,再加入氯水(或其他氧化剂)出现血红色。滤液A中含有Fe2+、Al3+、Cu2+,加入足量NaOH溶液后得到的固体混合物D为Fe(OH)3和Cu(OH)2,在空气中灼烧后得到的固体混合物F为Fe2O3和 CuO,滤液C中含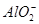 ,则金属单质E为Al,利用铝热反应可焊接钢轨。(4)NaAlO2溶液中水的电离受到促进,而NaOH溶液中水的电离受到抑制。设两种溶液的pH=a,NaAlO2溶液中水电离出的c(OH-)为10a-14mol·L-1,NaOH溶液中水电离出的c(OH-)为10-amol·L-1,10a-14=108×10-a,得a=11。(5)用稀H2SO4溶解粗Cu中的活泼金属。
,则金属单质E为Al,利用铝热反应可焊接钢轨。(4)NaAlO2溶液中水的电离受到促进,而NaOH溶液中水的电离受到抑制。设两种溶液的pH=a,NaAlO2溶液中水电离出的c(OH-)为10a-14mol·L-1,NaOH溶液中水电离出的c(OH-)为10-amol·L-1,10a-14=108×10-a,得a=11。(5)用稀H2SO4溶解粗Cu中的活泼金属。
