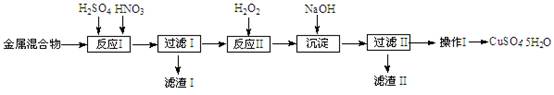
(10分)信息时代产生的大量电子垃圾对环境构成严重威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含Cu、Fe及少量Au、Pt等金属的混合物,并用如下流程制备胆矾晶体(CuSO4•5H2O):
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀 | 1.5 | 6.4 | 4.2 |
| 完全沉淀 | 3.2 | 8.9 | 6.7 |
(2)反应Ⅱ中加入H2O2的作用是______。
(3)沉淀过程中发生反应的离子方程式有______、______。
(4)操作Ⅰ的步骤是______、______、过滤、洗涤、干燥。
(5)测定胆矾晶体纯度的实验步骤如下:
a. 准确称取3.125g胆矾晶体样品配成100mL溶液;
b. 取10.00 mL溶液于带塞锥形瓶中,加适量水稀释,加入过量KI固体,发生反应:
2Cu2+ +4Iˉ=2CuI↓ + I2
c. 继续向上述混合物中,逐滴加入0.1000 mol·L-1Na2S2O3溶液至恰好完全反应,共消耗12. 00mL Na2S2O3溶液:I2+2S2O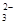 = 2Iˉ+S4O
= 2Iˉ+S4O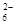
求样品中胆矾晶体的质量分数(写出计算过程)。
(1)Au、Pt (2)使Fe2+氧化为Fe3+
(3)H+ + OHˉ = H2O Fe3+ + 3OHˉ= Fe(OH)3↓
(4)蒸发浓缩 冷却结晶
(5)96%(无计算过程不得分)
解:n(Na2S2O3) = 0.012L×0.1000mol·L-1=" 0.0012" mol
2CuSO4·5H2O~I2~2S2O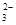
n(CuSO4·5H2O) = n(Na2S2O3) =" 0.0012" mol
m(CuSO4·5H2O) =" 0.0012" mol×250g·mol-1 = 0.30g
w(胆矾) =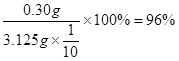
题目分析:⑴在金属混合物中只有Au、Pt不溶于硝酸,故滤渣Ⅰ的主要成份是Au、Pt。
⑵过滤I的滤液中含有Cu2+、Fe3+、Fe2+,根据这些阳离子以氢氧化物形式沉淀时溶液的pH可知,加入H2O2将Fe2+氧化为Fe3+,才能将铁转化为Fe(OH)3沉淀除去。
⑶在沉淀过程中加入NaOH,中和H+(H+ + OHˉ = H2O),提高pH使Fe3+转化Fe(OH)3沉淀(Fe3+ + 3OHˉ= Fe(OH)3↓)。
⑷过滤Ⅱ的滤液中含有CuSO4,通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得胆矾晶体。
⑸详见参考答案的解答过程
