(10分) 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500 mL 0.5 mol·L-1的硫酸溶液中,右图为反应产生氢气速率与反应时间的关系图。
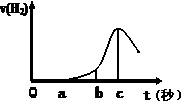
(1)关于图像的描述不正确的是 (填序号,下同);
① o→a段不产生产生H2是室温过低,反应难以发生。
② b → c段产生H2较快可能是反应放热,温度升高,加快了反应
③ c以后,产生H2速率逐渐下降原因可能是铝片趋于消耗完全
(2)在b到c这段时间内,收集到氢气VL(标准状况),则这段时间内用硫酸表示的平均速率为 mol/(L·s)(假设反应前后溶液体积不变)。
(3)其他条件不变,现换用500 mL 1 mol·L-1盐酸,产生氢气速率普遍较使用500 mL 0.5 mol·L-1硫酸的快,可能的原因是________;
(4)要加快铝与硫酸溶液制H2的反应速率,小组成员提出一系列方案,合理的有
①加入2 mol·L-1硝酸②加入少量CuSO4溶液 ③将铝片换成铝粉 ④增加硫酸的浓度至18 mol/L ⑤加CH3COONa固体; ⑥加入少量Na2SO4溶液
(5)催化剂会影响反应速率,请根据①反应写出FeCl3催化H2O2分解的另一反应原理(用离子方程式)①2Fe3++ H2O2= 2Fe2++ 2H+ +O2↑;② ;
(1)①③;(2)V/11.2(c—b) mol/(L·s);(3)氯离子由催化作用或硫酸根由阻化作用;(4)②③;(5)②2Fe2+ + H2O2 + 2H+====2Fe3+ + 2H2O。
题目分析:(1)① o→a段不产生产生H2是由于金属铝表面有一层氧化膜,氧化铝与稀硫酸反应生成硫酸铝和水,错误;② b → c段产生H2较快可能是反应放热,温度升高,加快了反应,正确;③ 根据题给数据知,铝过量,c以后,产生H2速率逐渐下降原因可能是稀硫酸趋于消耗完全,错误,选①③;(2)在b到c这段时间内,收集到氢气VL(标准状况),物质的量为V/22.4mol,时间为(c—b)s,硫酸的物质的量变化为V/22.4mol,则这段时间内用硫酸表示的平均速率为V/11.2(c—b) mol/(L·s);(3)其他条件不变,现换用500 mL 1 mol·L-1盐酸,产生氢气速率普遍较使用500 mL 0.5 mol·L-1硫酸的快,可能的原因是氯离子由催化作用或硫酸根由阻化作用;(4)①加入2 mol·L-1硝酸,硝酸具有强氧化性,与铝反应不放氢气,错误;②加入少量CuSO4溶液,铝置换出铜,形成原电池,反应速率加快,正确; ③将铝片换成铝粉 ,增大反应物的接触面积,反应速率加快,正确;④增加硫酸的浓度至18 mol/L ,铝遇浓硫酸钝化,阻止反应进行,错误;⑤加CH3COONa固体,硫酸与醋酸钠反应生成醋酸,氢离子浓度较小,反应速率减慢,错误; ⑥加入少量Na2SO4溶液,将硫酸稀释,反应速率减慢,错误,选②③;(5)催化剂会影响反应速率,请根据①反应写出FeCl3催化H2O2分解的另一反应原理(用离子方程式)①2Fe3++ H2O2= 2Fe2++ 2H+ +O2↑;②2Fe2+ + H2O2 + 2H+====2Fe3+ + 2H2O。
