问题
实验题
用氢气还原氧化铜的方法测定某氧化铜样品的纯度(杂质不与氢气反应),同学们设计了以下实验装置,准确称取15克干燥样品进行实验.
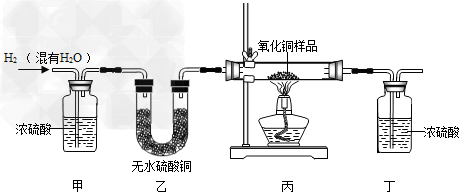
(1)在实验中,乙装置的作用是 .
(2)准确称取完全反应前后装置丙和丁的质量如表:

小丽想根据装置丁的质量变化进行计算,请帮小丽求出氧化铜样品的纯度(写出计算过程).
(3)比较两种计算结果,请分析导致这一结果的原因可能是 .
A.装置的气密性不好
B.空气中的水分被丁处浓硫酸吸收
C.通入的氢气量不足
D.空气中的二氧化碳被丁处浓硫酸吸收 .
答案
(1)检验氢气中水分是否全部被吸收;
(2)根据浓硫酸质量的增加量就是生成的水的质量,所以生成水的质量为:
163.9g﹣161.2g=2.7g,
设要生成2.7g水需要参加反应的氧化铜的质量为X则:
H2+CuO Cu+H2O
Cu+H2O
80 18
X 2.7g
根据: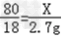 解得X=12g,
解得X=12g,
所以氧化铜的质量分数: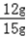 ×100%=80%
×100%=80%
答:氧化铜样品的纯度为80%.
80%;
(3)B.
