问题
单项选择题
下列哪种情况不属于消费者均衡条件( )
A.
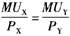
B.货币在每种用途上的边际效用相等
C.MU=λP(λ表示单位货币的边际效用)
D.各种商品的边际效用相等
答案
参考答案:D
解析:
[分析]:
消费者达到均衡的原则可用数学公式表述为:
[*]
式中,MUX、MUY、PX、PY分别表示商品X和Y的边际效用和单位价格;λ表示单位货币的边际效用。这一原则的经济学含义是,消费者用每1单位货币买到的边际效用相等时,消费者就从购买的消费品中获得最大限度的满足或者说效用。
显然,应该是各种商品的边际效用与其价格之比相等,而不是各种商品的边际效用相等。因此,本题应选D。
