通过海水提取的粗盐中含有MgCl2、CaCl2、MgSO4.以及泥沙等杂质.以下是一种制备精盐的实验方案(用于沉淀的试剂均过量).
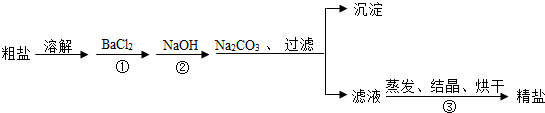
请回答下列问题:
(1)步骤①中的BaCl2不能改成Ba(NO3)2,其原因是什么?
(2)进行步骤①后,如何判断BaCl2是否过量?
(3)加入Na2CO3的目的是什么?
(4)以上粗盐提纯的有关操作中需用到的主要仪器有哪些?
(5)该实验方案还需完善,请写出具体的操作步骤.
(1)在除杂质的同时不能引入新的杂质,加入硝酸钡会生成新的杂质硝酸钠,故答案为:这样会在溶液中引入硝酸根离子.
(2)要除去杂质,需加入过量的除杂物质,要判断BaCl2是否过量,可取少量上层清液,继续滴加BaCl2溶液,如没有白色沉淀出现,则说明BaCl2过量;
(3)在②步后,溶液中存在的物质有:未反应的氯化钡、氯化钙,要将钡离子和钙离子除去,但是不能引入新的杂质,所以加入碳酸钠;
(4)粗盐提纯的步骤是:溶解、过滤、蒸发;溶解时要用到烧杯、玻璃棒;过滤还要用到漏斗;蒸发时用到蒸发皿、酒精灯、铁架台、坩埚钳等;
(5)过滤后滤液的主要成分有:NaCl、NaOH、Na2CO3;要得到纯净的氯化钠,此实验方案尚需完善,具体步骤是:向滤液中加入适量的稀盐酸,以除去氢氧化钠和碳酸钠;
故答案为:
(1)因为会引入新的杂质离子NO3-;
(2)取少量上层清液,继续滴加BaCl2溶液,如没有白色沉淀出现,则说明BaCl2过量;
(3)除去CaCl2及过量的BaCl2;
(4)烧杯、玻璃棒、漏斗、蒸发皿、酒精灯、铁架台、坩埚钳等;
(5)向滤液中加入适量的稀盐酸以除去氢氧化钠和碳酸钠.
