在下列物质转化关系中,反应的条件和部分产物已略去。
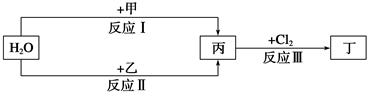
回答下列问题:
(1)若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应。
①反应Ⅰ中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是________(填字母)。
A.热分解法 B.热还原法 C.电解法
②反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是______________________________________。
③通过比较反应Ⅰ、Ⅱ的反应条件,可得出甲的金属性比乙的金属性________(填“强”或“弱”),比较二者金属性强弱的依据还可以是(写出一种即可)__________________。
(2)若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应。
①反应Ⅲ的化学方程式是__________________________________________________。
②反应Ⅰ的另一种产物为有机物,则该有机物的电子式是______________。
③在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体。其反应的离子方程式是______________________________________________。
(1)①C ②3Fe+4H2O(g)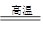 Fe3O4+4H2 ③强 元素最高价氧化物对应的水化物的碱性:NaOH>Fe(OH)3(其他合理答案也可)
Fe3O4+4H2 ③强 元素最高价氧化物对应的水化物的碱性:NaOH>Fe(OH)3(其他合理答案也可)
(2)①2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O ②H:C⋮⋮C:H ③2Cl2+H2O+CaCO3=CaCl2+2HClO+CO2
(1)由题意知,丙为H2,①甲为Na,制备金属钠用电解法。②乙为铁,3Fe+4H2O(g)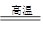 Fe3O4+4H2。③Na在常温下和水剧烈反应,而Fe与H2O(g)需高温下反应,Na的金属性强,比较Na、Fe的金属性强弱,还可以比较它们的最高价氧化物对应的水化物碱性强弱。(2)丙为Ca(OH)2。①2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
Fe3O4+4H2。③Na在常温下和水剧烈反应,而Fe与H2O(g)需高温下反应,Na的金属性强,比较Na、Fe的金属性强弱,还可以比较它们的最高价氧化物对应的水化物碱性强弱。(2)丙为Ca(OH)2。①2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
②CaC2和H2O反应除生成Ca(OH)2外,还生成C2H2,他的电子式为H:C⋮⋮C:H。③Cl2+H2O HCl+HClO,2HCl+CaCO3=CaCl2+H2O+CO2↑,上述两式合并得2Cl2+H2O+CaCO3=CaCl2+2HClO+CO2。
HCl+HClO,2HCl+CaCO3=CaCl2+H2O+CO2↑,上述两式合并得2Cl2+H2O+CaCO3=CaCl2+2HClO+CO2。
