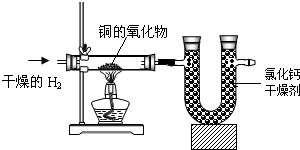
某同学以右图所示的装置完成某化合物的组成分析实验,实验结果如下表所示:
| 实验前 | 实验后 | |
| (铜的氧化物+玻璃管) 的质量 | 137.8g | 131.4g |
| (氯化钙+U形管) 的质量 | 100.8g | 108.0g |
(1)完全反应后生成的水的质量是______;
(2)生成的水中氧元素的质量是______;
(3)铜的氧化物中铜元素的质量是______;
(4)铜的氧化物中铜和氧两种元素的质量比______;
(5)该铜的氧化物中铜、氧两种元素的原子个数比是______;
(6)该铜的氧化物的化学式为______.
(1)完全反应生成的水,由于被干燥剂氯化钙所吸收,因此水的质量为:108.0g-100.8g═7.2g;
(2)由于水的质量为7.2g,所以水中氧元素的质量:7.2g×
═6.4g,故答案为:6.4g16 18
(3)铜的氧化物中氧元素就是生成的水中氧元素的,所以铜元素的质量:137.8g-80.2g-6.4g=51.2g;
(4)铜的氧化物中有氧元素6.4g,铜元素51.2g,因此铜、氧元素的质量比为:51.2g:6.4g=8:1;
(5)可以根据元素的质量比直接求元素的原子个数比,氧化物中铜、氧元素的原子个数比为:
:8 64
=2:1,1 16
(6)铜的氧化物中铜、氧元素的原子个数比为2:1,该铜的氧化物的化学式为:Cu2O.
故答案为:
(1)7.2克;(2)6.4克;(3)51.2克;(4)8:1;(5)2:1;(6)Cu2O.
