下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是地壳中含量最高的金属,K是一种红棕色气体,过量G与J溶液反应生成M。
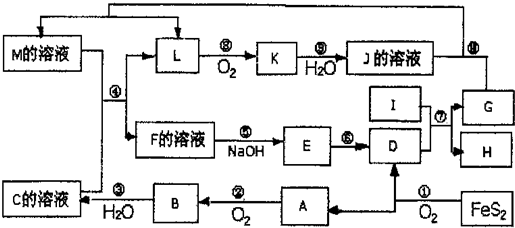
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第_______周期第_______族。
(2)在反应⑦中还原剂与氧化剂的物质的量之比为___________________。
(3)简述M溶液中阳离子的检验方法 。
(4)某同学取F的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 。
(5)将化合物D与KNO3、KOH高温共熔,可制得一种“绿色”环保高效净水剂K2FeO4,同时还生成KNO2和H2O,该反应的化学方程式是_________________________。
(6)镁与金属I的合金是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg与金属I的单质在一定温度下熔炼获得。
①熔炼制备该合金时通入氩气的目的是 。
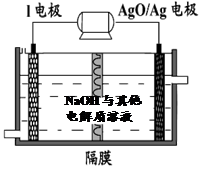
② I电池性能优越,I-AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为 。
(1)四 Ⅷ(2分)(2)2:1(2分)
(3)取出部分溶液于试管中加入KSCN,溶液没有变化,再加入少量氯水,溶液变为红色(其他合理答案) (2分)(4)2Fe3++2I-=2Fe2++I2(2分)
(5)Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O(2分)(6)① 防止Mg、Al被空气氧化(2分)
2K2FeO4+3KNO2+2H2O(2分)(6)① 防止Mg、Al被空气氧化(2分)
②2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O(2分)
题目分析:FeS2氧化得到的A可以继续被氧化,则A为SO2,B为SO3,C为B的水化物,C为H2SO4,D为Fe2O3,I为地壳中含量最高的金属,应为Al,反应⑦为铝单质与金属氧化物所发生的置换反应,即铝热反应.K是一种红棕色气体,为NO2,则J为HNO3,L被氧化成为NO2,故L可能为氨或NO2,由于C溶液,即硫酸溶液能与某M溶液反应得到L,故L不可能是碱性的气体氨气,故L为NO,G能与硝酸反应并能产生NO,故G为Fe,H为Al2O3。过量G与J溶液反应生成M,因此M应该是硝酸亚铁。由于D为Fe2O3,而由框图中可知E为氢氧化物,E经由一步转变为D,故E为Fe(OH)3,而E直接由F加入碱而得到,故F为三价铁离子,其阴离子可能为硫酸根与硝酸根的混合物,或者是仅有硫酸根离子,由于题目所给物质名称仅为F,故可知F为纯净物硫酸铁,则
(1)在周期表中,组成单质G的元素是铁位于第四周期第Ⅷ族。
(2)反应⑦是铝与氧化铁的铝热反应,方程式为2Al+Fe2O3 2Fe+Al2O3,其中还原剂是铝,氧化剂是氧化铁,因此还原剂与氧化剂的物质的量之比为2:1。
2Fe+Al2O3,其中还原剂是铝,氧化剂是氧化铁,因此还原剂与氧化剂的物质的量之比为2:1。
(3)亚铁离子具有还原性,因此M溶液中亚铁离子的检验方法为取出部分溶液于试管中加入KSCN,溶液没有变化,再加入少量氯水,溶液变为红色。
(4)铁离子具有氧化性,能把碘离子氧化生成单质碘,则反应的离子方程式为2Fe3++2I-=2Fe2++I2。
(5)根据电子得失守恒以及原子守恒可知,该反应的化学方程式是Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O。
2K2FeO4+3KNO2+2H2O。
(6)①镁和铝都是活泼的金属,极易被氧化,因此熔炼制备该合金时通入氩气的目的是防止Mg、Al被空气氧化。
②原电池中活泼的金属作负极失去电子被氧化,因此该原电池中铝是负极失去电子,AgO得到电子,由于电解质是氢氧化钠所以总的化学方程式为2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O。
