A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题:
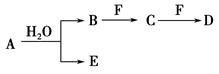
(1)若常温下A为有色气体。
①当F是一种金属单质时,请写出一定浓度的B溶液和适量F反应生成C与气体E的离子方程式:______________________________________________。
②当C为直线形分子时,E具有漂白性,物质F焰色反应呈黄色,则C的电子式为________;D中所含化学键的类型为________。
(2)若A为淡黄色固体,D为白色难溶于水的物质,且A和D的式量相等,请用离子方程式表示F的水溶液呈酸性的原因:_______________________。
(3)若A中一种元素原子的最外层电子数为内层电子总数的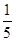 ,将B和D分别溶于水,所得溶液按恰当比例混合,可得一种不含金属元素的盐溶液,请写出A与H2O反应的化学方程式:_____________________________________;
,将B和D分别溶于水,所得溶液按恰当比例混合,可得一种不含金属元素的盐溶液,请写出A与H2O反应的化学方程式:_____________________________________;
B转化为C的化学方程式为_______________________________________。
(1)①Fe+4H++NO3—=Fe3++NO↑+2H2O
②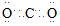 离子键、极性共价键 (2)Al3++3H2O
离子键、极性共价键 (2)Al3++3H2O Al(OH)3+3H+ (3)Mg3N2+6H2O=3Mg(OH)2+2NH3↑ 4NH3+5O2
Al(OH)3+3H+ (3)Mg3N2+6H2O=3Mg(OH)2+2NH3↑ 4NH3+5O2 4NO+6H2O
4NO+6H2O
(1)①A为有色气体,和水反应后生成一种气体E和能与金属反应的物质B,且B能连续和金属F反应,可知F为变价金属,可推断B为硝酸,F为Fe,C为Fe(NO3)3,D为Fe(NO3)2,A为NO2,E为NO。②E具有漂白性且A为有色气体,可推断A为Cl2,E为HClO,则B为盐酸;C为直线形分子,根据题意可推断C为CO2;根据焰色反应可推断F为Na2CO3,则D为NaHCO3,D中含有离子键和极性共价键。(2)A为淡黄色固体且能和水反应,可推断A为Na2O2;D为白色沉淀,且A和D的式量相等,所以D为Al(OH)3,B为NaOH,F中含有Al3+,C中含有AlO2—,F的水溶液呈酸性是因为Al3+发生水解反应。(3)根据核外电子数的关系可知A中含有镁元素,B和D溶于水得到一种不含金属元素的盐,可推断其为铵盐,由B→C→D可推断B、C、D中都含有氮元素,所以A为Mg3N2,B为NH3,F为O2,C为NO,D为NO2。
