(15分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是第三周期原子半径最小的金属元素组成的单质,D是一种红棕色固体粉末,G为单质,K是一种红棕色气体,A、B相对分子质量相差16,J、C都是常见的强酸。
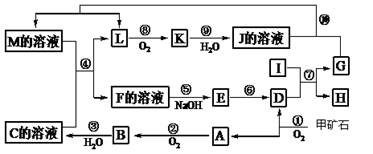
请填写下列空白:
(1)写出下列物质的化学式B E 。
(2)反应⑦的化学方程式为 。反应⑦属于 。
A.吸热反应 B.放热反应 C.置换反应 D.氧化还原反应
(3)反应⑩的离子方程式为 。
(4)将化合物D与KNO3、KOH混合,在高温条件下可制得一种“绿色”环保高效净水剂K2GO4(G显+6价),同时还生成KNO2和H2O。该反应的化学方程式是: 。
(5)反应①中生成的A、D物质的量之比为4:1,已知甲矿石的主要成分是由两种元素组成的化合物,则该化合物的化学式为 。
(1)B SO3 E Fe(OH)3; (2) Fe2O3+ 2Al Al2O3+2Fe 。反应⑦属于 BCD 。
Al2O3+2Fe 。反应⑦属于 BCD 。
(3) 3Fe+2NO3- +8H+ = 3Fe2++2NO↑+4H2O 。
(4) Fe2O3+3KNO3+4KOH  2K2FeO4+3KNO2+2H2O。(5) FeS2。
2K2FeO4+3KNO2+2H2O。(5) FeS2。
题目分析:(1)甲矿石是FeS2,矿石煅烧得到A:SO2和D:Fe2O3;SO2与O2发生反应得到B:SO3,SO3与水作用得到C:硫酸;I是Al,Al与Fe2O3发生铝热反应:Fe2O3+ 2Al Al2O3+2Fe,得到的G的Fe;H是Al2O3。E是Fe(OH)3;F是Fe2(SO4)3和Fe(NO3)3的混合物,M是Fe(NO3)2.L是NO;K是NO2,J是 HNO3。(1)B是SO3;E是Fe(OH)3;(2)反应⑦的铝热反应的化学方程式为Fe2O3+ 2Al
Al2O3+2Fe,得到的G的Fe;H是Al2O3。E是Fe(OH)3;F是Fe2(SO4)3和Fe(NO3)3的混合物,M是Fe(NO3)2.L是NO;K是NO2,J是 HNO3。(1)B是SO3;E是Fe(OH)3;(2)反应⑦的铝热反应的化学方程式为Fe2O3+ 2Al Al2O3+2Fe,铝热反应是放热反应,因为符合置换反应的定义,所以属于置换反应,有元素的化合价的升高与降低,所以也是氧化反应反应。因此选项是B、C、D。(3)足量的Fe与硝酸反应的离子方程式是3Fe+2NO3- +8H+ = 3Fe2++2NO↑+4H2O;(4)根据题意可得相应的反应的方程式是:Fe2O3+3KNO3+4KOH
Al2O3+2Fe,铝热反应是放热反应,因为符合置换反应的定义,所以属于置换反应,有元素的化合价的升高与降低,所以也是氧化反应反应。因此选项是B、C、D。(3)足量的Fe与硝酸反应的离子方程式是3Fe+2NO3- +8H+ = 3Fe2++2NO↑+4H2O;(4)根据题意可得相应的反应的方程式是:Fe2O3+3KNO3+4KOH  2K2FeO4+3KNO2+2H2O。(5)反应①中生成的SO2和Fe2O3物质的量之比为4:1,已知甲矿石的主要成分是由两种元素组成的化合物,则该化合物中n(Fe):n(S)=2:4=1:2因此甲的化学式为FeS2。
2K2FeO4+3KNO2+2H2O。(5)反应①中生成的SO2和Fe2O3物质的量之比为4:1,已知甲矿石的主要成分是由两种元素组成的化合物,则该化合物中n(Fe):n(S)=2:4=1:2因此甲的化学式为FeS2。
