问题
计算题
(5分)某实验小组在一定量的石灰水中通入CO2,产生沉淀的质量与通入CO2 质量的关系如下图所示,已知反应:CaCO3+H2O+CO2=Ca(HCO3)2,Ca(HCO3)2易溶于水。
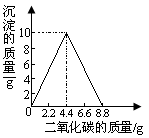
(1)请描述实验过程中可能观察到的现象: (2分)。为使溶液的溶质在整个实验过程中为最大值,理论上至少应通入CO2 质量是 。
(不考虑CO2气体在水中的溶解)
(2)请计算通CO2气体前石灰水中溶质的质量。(请写出计算过程,2分)
答案
⑴先浑浊,后澄清 8.8g (2) 7.4g
题目分析:(1) 一定量的石灰水中通入CO2,发生反应:CO2 +Ca(OH)2 ==CaCO3↓+ H20,继续通入CO2,又发生反应::CaCO3+H2O+CO2=Ca(HCO3)2,故实验过程中可能观察到的现象:先浑浊,后澄清,通过观察图中的数据,为使溶液的溶质在整个实验过程中为最大值,理论上至少应通入CO2 质量是8.8g
(2)根据图中的数据,可知当通入的CO2 质量是4.4g时,恰好与石灰水中溶质Ca(OH)2完全反应,再根据反应:CO2 +Ca(OH)2 ==CaCO3↓+ H20中CO2与Ca(OH)2的质量关系,即可求出石灰水中溶质的质量
⑵解:设澄清石灰水中溶质Ca(OH)2的质量为x
CO2+ Ca(OH) 2 ="===" CaCO3↓+ H2O
44 74
4.4g x
44/74=4.4g/x x=7.4g
答:澄清石灰水中溶质Ca(OH)2的质量为7.4g
