某固态混合物中含有mgKNO3和若干不溶于水的杂质,将此混合物加入ng水中,在10℃、40℃、75℃时观察,充分溶解后的结果如下(溶解度曲线如图所示):
| 温度 | 10℃ | 40℃ | 75℃ |
| 未溶固体 | 261g | 175g | 82g |
(1)m、n的值各为多少?
(2)75℃时所得溶液是否饱和?
(3)在什么温度将mg硝酸钾溶于ng水中恰好达到饱和状态?
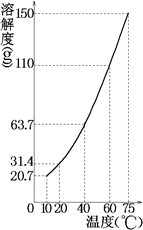
(1)根据硝酸钾溶解度曲线,温度从10℃升高至40℃时,硝酸钾的溶解度从20.7g增大到63.7g,溶解度增加了
63.7g-20.7g=43g,而实验中溶解硝酸的质量增加了261g-175g=86g,因此可得知实验中所用水n为200g;200g水在
10℃最多溶解硝酸钾20.7g×2=41.4g,则原固体混合物质量为41.4g+261g=302.4g;温度从40℃升高75℃时,硝酸钾的溶解度增加了150g-63.7g=86.3g,则200g水从40℃升温至75℃时可以多溶解硝酸钾的质量为86.3g×2=172.6g,而实验中固体质量只减少了175g-82g=93g,说明所剩余82g固体不含硝酸钾,全部为不溶于水的杂质,则所取硝酸钾的质量=302.4g-82g=220.4g,故答案为:m=220.4g,n=200g;
(2)根据以上分析,由溶解度曲线可知200g水从40℃升温至75℃时,需要溶解硝酸钾的质量为86.3g×2=172.6g溶液才能继续饱和,但由表中数据可知只有93g硝酸钾继续溶解,因此此时的硝酸钾溶液为不饱和溶液,
故答案为:75℃时所得KNO3溶液不饱和;
(3)n g水中恰好溶解m g硝酸钾,此时硝酸钾的溶解度=
×100g=110.2g,根据溶解度曲线可查得,此时温度约为60℃,故答案为:故答案为:60℃.220.4g 200g
