问题
问答题
有CO与CO2的混合气体共33.6L,其密度为1.7g/L,已知混合气体共有9.03×1023个分子,则该混合气体的平均摩尔质量是多少?CO与CO2的分子个数比是多少?
答案
混合气体的物质的量:
=1.5mol9.03×1023 6.02×1023mol-1
混合气体的质量:33.6L×1.7g/L=57.12g
混合气体的平均摩尔质量:
=. M
=38.08g/mol33.6L×1.7g/L 1.5mol
取混合气体的平均摩尔质量近似为38g/mol,利用十字交叉法来求算CO与CO2的分子个数比:
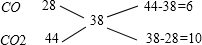
所以,N(CO):N(CO2)=6:10=3:5