(9分)乙醛(CH3CHO)在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次,反应基本完全。有关物质的沸点见下:
| 物质 | 乙醛 | 乙酸 | 甘油 | 乙醇 | 水 |
| 沸点/℃ | 20.8 | 117.9 | 290 | 78.2 | 100 |
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)
_________________________________________。
(2)如图所示,在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温
度计水银球的位置应在________;当试管A内的主要反应完成后温度计水银球的位置应在_______。
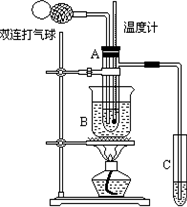
(3)烧杯B内盛装的液体可以是_______。
(4)试管C中收集到的是粗产品,若想进一步提纯,可采用的方法是_____;
提纯后的产品若在质谱仪中进行测定,其质荷比最大是____(填数值);
若在核磁共振仪中进行测定,其核磁共振氢谱共有__种峰,峰面积之比为__。
(1)2CH3CHO+O2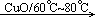 2CH3COOH。
2CH3COOH。
(2)浸入试管A的反应液中。试管A的支管口处。
(3)甘油。 (4)蒸馏;60;2;3:1或1:3。
(1)在加热并有从;催化剂的条件下乙醛可发生氧化反应生成乙酸,方程式为2CH3CHO+O2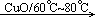 2CH3COOH。
2CH3COOH。
(2)反应开始阶段,需要控制溶液的温度,所以应插入溶液中。当反应结束后需要通过蒸馏分离乙酸,才是需要控制蒸汽的温度,所以应放在试管A的支管口处。
(3)因为乙酸的沸点大于100℃,所以烧杯内液体的温度就必须大于乙酸的沸点,根据表中数据可知需要用甘油。
(4)生成的乙酸会混有没有反应的乙醛,而乙醛的沸点和乙酸的差别很大,所以可以继续通过蒸馏得到乙酸。根据乙酸的分子式CH3COOH可知质荷比最大是是60.乙酸分子中含有2中不同类型的氢原子,其个数比为3:1或1:3。
