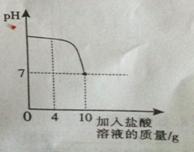
实验室中有一瓶标签被腐蚀的盐酸,小丽为了测定溶液中溶质的质量分数,在烧杯中配制了8克10%的氢氧化钠溶液,然后往烧杯中滴加该盐酸,反应过程中溶液的pH与滴入盐酸的质量关系如图所示。请回答下列问题:
(1)配制8克10%的氢氧化钠溶液,需要水的质量为 g;
(2)计算该盐酸的溶质质量分数;(写出计算过程)
(3)当滴入4克盐酸时,烧杯内溶液中钠元素的质量为 g。
(1)7.2;(2)7.3%;(3)0.46
题目分析: (1)根据溶液的质量=溶质的质量+溶剂的质量,故所加水的质量为:8g-8g×10%="7.2" g(2分)
(2)解:设盐酸中氯化氢的质量为x。
NaOH + HCl = NaCl + H2O
40 36.5
8g×10% x
40/36.5 =" 8g×10%/" x
x =" 36.5" ×0.8g/40 = 0.73g
盐酸溶液中溶质的质量分数="0.73g÷10g×100%" =7.3%
答:盐酸溶液中溶质的质量分数为7.3%。(设、答全对给1分)
(3)根据质量守恒定律可知溶液中钠元素的质量为:8g×10%×23/40×100%= 0.46g
