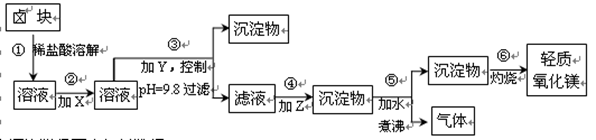
(16分)卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子。以卤块为原料按下图所示流程进行生产,可制得轻质氧化镁。
查阅资料得下表相关数据:
| 表1: 生成氢氧化物沉淀的pH | 表2: 原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的 (选填试剂编号)。
(2)步骤②发生反应的离子方程式为 ;步骤⑤中发生反应的化学方程为 。
(3)步骤③控制pH=9.8的目的是 。
(4) 若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、 和
泥三角。
(5)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量
NH4Cl晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原
因 。
(16分)
(1)a、c、d(各1分)
(2)2Fe2+ + ClO— + 2H+ = Cl— +2Fe3++ H2O;MgCO3 + H2O△Mg(OH)2+ CO2↑(各3分)
(3)使Mg2+以外的杂质尽可能彻底地转化为沉淀除去(2分)
(4)坩埚 (2分)
(5)Mg(OH)2(s)  Mg2+ (aq)+ 2OH-(aq); NH4Cl 电离出的NH4+与OH-结合成弱电解质NH3·H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动(3分)。
Mg2+ (aq)+ 2OH-(aq); NH4Cl 电离出的NH4+与OH-结合成弱电解质NH3·H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动(3分)。
题目分析:(1)流程图中加入X的目的是将亚铁离子氧化为铁离子,考虑氧化剂的价格,应该选择漂粉;加入Y的目的是调节溶液的pH,使铁离子、锰离子沉淀,碳酸钠溶液显碱性,但碱性不强,所以选择用氢氧化钠;加入Z的目的是使镁离子沉淀,所以选择碳酸钠,且加水煮沸,使生成的碳酸镁沉淀转化为氢氧化镁沉淀,成本较低,因此试剂X、Y、Z最佳选择依次是表2中的a、c、d;
(2)加入NaClO的目的是将亚铁离子氧化为铁离子,离子方程式为2Fe2+ + ClO— + 2H+ = Cl— +2Fe3++ H2O;步骤⑤是把碳酸镁沉淀转化为氢氧化镁,化学方程式为MgCO3 + H2O△Mg(OH)2+ CO2↑;
(3)根据表1中的数据可知,pH=9.8时铁离子、锰离子完全沉淀,而镁离子开始沉淀,而流程的要求是产品尽量不含杂质,所以步骤③控制pH=9.8的目的是使Mg2+以外的杂质尽可能彻底地转化为沉淀除去;
(4)灼烧时用到的仪器有铁三脚、酒精喷灯、坩埚和泥三角。
(5)NH4Cl溶液中的铵根离子与溶解平衡中Mg(OH)2(s)  Mg2+ (aq)+ 2OH-(aq)的氢氧根离子结合生成弱电解质NH3·H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动,所以氢氧化镁逐渐溶解。
Mg2+ (aq)+ 2OH-(aq)的氢氧根离子结合生成弱电解质NH3·H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动,所以氢氧化镁逐渐溶解。
