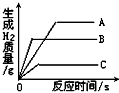
某溶液中可能含有OH-、CO32—、AlO2—、SiO32—、SO42—、K+、Na+、Fe3+、Mg2+、Al3+等离子,当向溶液中逐滴加入一定物质的量浓度的盐酸时,生成沉淀的物质的量与加入盐酸体积的关系如图所示[已知:AlO2—+HCO3—+H2O=Al(OH)3↓+CO32—]。回答下列问题:

(1)原混合溶液中一定含有的离子是________;
(2)AB段反应的离子方程式是__________________________;
(3)AB段和盐酸反应的离子与BC段和盐酸反应的物质的物质的量之比为______________。
(1)OH-、CO32—、AlO2—、SiO32—
(2)H++CO32—=HCO3—、H++HCO3—=CO2↑+H2O
(3)3∶4
从图中可以看出最初加入盐酸未产生沉淀,且AlO2—+HCO3—+H2O=Al(OH)3↓+CO32—,所以一定有OH-,则可以排除Fe3+、Mg2+、Al3+的存在;产生的沉淀只有部分溶解,则一定有AlO2—、SiO32—,AB段消耗了盐酸,沉淀却未溶解,则一定有CO32—。AB段为CO32—与盐酸反应,BC段为Al(OH)3与盐酸反应,根据盐酸的消耗量可知两者的物质的量之比为3∶4。