(12分)(1)已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸 Ki = 1.75×10-5
碳酸 Ki 1= 4.30×10-7 Ki 2 = 5.61×10-11
亚硫酸 Ki 1= 1.54×10-2 Ki 2 = 1.02×10-7
写出碳酸的第一级电离平衡常数表达式:Ki = _ __
在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性最强的是
③ 若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是 (填序号)
A. c(CH3COO-) B. c(H+) C. w醋酸电离平衡常数 D. 醋酸的电离度
 (2)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数
(2)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数
Ksp=cm(An+)×cn(Bm-),称为难溶电解质的离子积。在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀。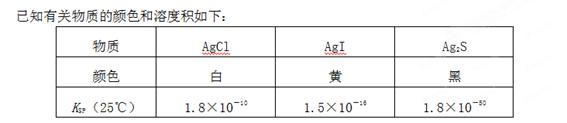
下列叙述不正确的是 
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.若先加入Na2S溶液,再加入KCl溶液,则无白色沉淀产生
C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 (填“A”或“B”)。
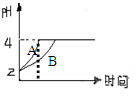
设盐酸中加入的Zn质量为m1, 醋酸溶液中加入的Zn质量为m2。则m1 m2(选填“<”、“=”、“>”)
(1)①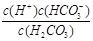 ② H2CO3 ③ A D (2)C
② H2CO3 ③ A D (2)C
(3)B,<
题目分析:(1)①写出碳酸第一步电离的电离方程式,根据电离平衡常数的表达式得Ki;②电离平衡常数越大,酸性越强,碳酸的酸性看第一步电离的平衡常数,HSO3-的酸性看亚硫酸的第二步电离的平衡常数Ki2;③加入盐酸,氢离子浓度增大,醋酸的电离平衡向左移动,电离程度减小,醋酸根离子的浓度减小,氢离子的浓度增大,电离平衡常数只与温度有关,故电离平衡常数不变,故选AD;(2)A、难溶的可以转化成更难溶的,故A正确;B、先生成了硫化银沉淀,因氯化银的溶解能力大,故不能转化成氯化银沉淀,故B正确;因三者的Ksp不相同,即溶解能力不相同,故三者的饱和溶液中的银离子的浓度不相同,故C错误;D、溶度积只与温度有关,与在哪种溶液中无关,故在两种溶液中的溶度积相同,故D正确;故选C;(3)开始时两溶液中的氢离子浓度相等,醋酸溶液中还存在醋酸的电离平衡,随着反应的进行,氢离子的消耗,醋酸的电离平衡向右移动,使氢离子的浓度增大,故醋酸溶液中的氢离子浓度减小的慢,故B曲线是醋酸;在pH相等,即开始氢离子浓度相等的条件下,醋酸的物质的量浓度大,故在体积相等的条件下,醋酸消耗的锌多。
