问题
问答题
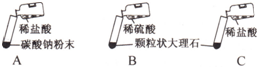
某实验小组的同学用碳酸钠粉末、颗粒状大理石、稀盐酸、浓盐酸、稀硫酸这几种药品,探究实验室制取CO2的反应原理.请你参与下列探究并回答问题.
[提出问题]上述几种酸和碳酸盐的反应是否适合在实验室制取CO2?
[问题说明](1)浓盐酸是否适合用于实验室制取CO2?请说明理由.
[方案设计]现有如下三个实验进行对比分析:
(2)请你完成实验报告中的有关内容的填写.
| 实验 | 实验现象 | 得出的结论 |
| A | 剧烈反应,迅速放出大量气泡 | 反应速率过快,气体不便收集,不宜于实验室制取CO2 |
| B | 产生气泡,速率迅速减慢,反应几乎停止 | 无法持续产生CO2,不能用于实验室制取CO2 |
| C | ______ | ______ |
[拓展与迁移]
(4)由上述探究可知,在确定实验室制取气体的反应原理时,应该考虑哪些因素?(写出两点即可)
答案
解;(1)因为浓盐酸易挥发出氯化氢气体,使制出的CO2不纯,因此浓盐酸不适合用于实验室制取CO2;(2)盐酸和大理石是实验室制取二氧化碳常用的药品,和A、B相比反应的现象是产生大量气泡,反应连续且持续时间较长;得出的结论是:反应速率适中,气体便于收集,因此可以用于实验室制取CO2;
(3)大理石和盐酸反应产生氯化钙、水和二氧化碳,反应的方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(4)由上述探究可知,在确定实验室制取气体的反应原理时,应该考虑的因素如:制得的气体较纯净,反应条件易满足,反应速率适中,不产生污染等.
故答案为:(3)CaCO3+2HCl═CaCl2+H2O+CO2↑;(4)制得的气体较纯净,反应条件易满足,反应速率适中,不产生污染等.
