根据下图所示装置回答问题:
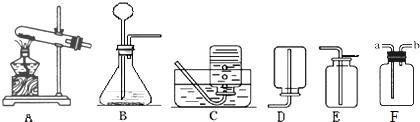
(1)实验室用大理石和稀盐酸反应制取二氧化碳,应选用的装置是______,请写出该反应的化学方程式:______.
(2)实验室用A装置加热高锰酸钾来制取氧气,需要改进的是______,反应的化学方程式为______.下列反应可使用A装置进行实验的是(填序号)______.
①过氧化氢溶液和二氧化锰制氧气; ②一氧化碳还原氧化铁; ③木炭还原氧化铜
(3)装置F可用来收集气体,还具有其他用途,如在F瓶中装入______,可用来干燥某些气体.若用F收集氧气并测量制得氧气的体积,需在瓶内先装满水,气体从______(填“a”或“b”)处导管通入,并需要补充的一种玻璃仪器是______.
(4)石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4g石灰石样品,把20g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:
| 稀盐酸的用量 | 第一次加入5g | 第二次加入5g | 第三次加入5g | 第四次加入5g |
| 剩余固体的质量 | 3g | 2g | l g | 1g |
(1)实验室用大理石和稀盐酸反应制取二氧化碳的原理是碳酸钙与盐酸反应生成氯化钙、水、二氧化碳,方程式为CaCO3+2HCl═CaCl2+CO2↑+H2O;药品为固体大理石和液体稀盐酸,反应条件是常温,发生装置选B;二氧化碳能溶于水,不能用排水法收集,其密度比空气大,用向上排空气法收集,装置为E.
(2)高锰酸钾受热易先变成纤细粉末,易随气流进入并堵塞导管,故要在试管口处放一团棉花;高锰酸钾受热分解生成锰酸钾、二氧化锰、氧气,方程式为2KMnO4
K2MnO4+MnO2+O2↑;A装置适宜涉及加热固体的反应,故可用于木炭还原氧化铜. 加热 .
(3)装置F是个“万能瓶”,因浓硫酸有吸水性,常作气体干燥剂,在F瓶中装入浓硫酸,可用来干燥某些气体;用F收集氧气并测量制得氧气的体积,需在瓶内先装满水,因水的密度比气体大,气体从b处导管通入,才能排出水,再添加一个量筒,通过量排出水的体积判断气体的体积.
(4)由表中数据可知:第三次加入5g稀盐酸后,样品中的碳酸钙已经完全反应,且碳酸钙的质量为3g.
设稀盐酸中溶质的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73
3g X
=100 73
X=2.19g3g X
稀盐酸的溶质质量分数为:
×100%=14.6%21.9g 15g
答:稀盐酸的溶质质量分数为14.6%.
故答案为:(1)B、E;CaCO3+2HCl═CaCl2+CO2↑+H2O;(2)需要在导管口处放一团棉花;2KMnO4
K2MnO4+MnO2+O2↑;③;(3)浓硫酸;b;量筒; 加热 .
(4)由表中数据可知:第三次加入5g稀盐酸后,样品中的碳酸钙已经完全反应,且碳酸钙的质量为3g.
设稀盐酸中溶质的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73
3g X
=100 73
X=2.19g3g X
稀盐酸的溶质质量分数为:
×100%=14.6%2.19g 15g
答:稀盐酸的溶质质量分数为14.6%.
