(14分)氧化锌是橡胶、油漆、搪瓷、电缆、医药、电子、化学等工业的重要原料。以氧
化锌粗品为原料制备活性氧化锌的生产工艺流程如下:
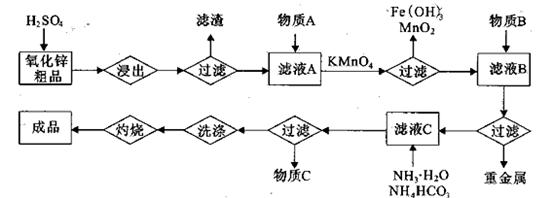
(1).浸出”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+、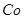 +、Mn2+等
+、Mn2+等
杂质。物质A的作用是调节溶液的pH至5 4,物质A最好选择________。
A.NH3.H2O
B.Na2CO3
C.H2SO4
D.ZnO已知25℃时部分金属离子从开始形成氢氧化物沉淀到沉淀完全时溶液的pH如下表:
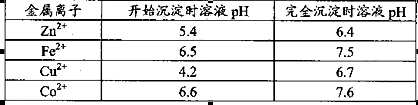
该温度下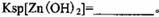 。
。
(2) KMnO4的作用是除去Mn2+和Fe2+,则KMnO4与Mn2+反应的离子方程式为_____________________________________;若溶液中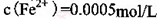 ,则处理1
,则处理1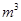 该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
(3)杂质Cu2+、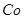 2+可利用置换反应除去,则物质B是_________。
2+可利用置换反应除去,则物质B是_________。
(4)被灼烧的沉淀是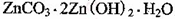 ,生成该沉淀的化学方程式为________。
,生成该沉淀的化学方程式为________。
如何检验该沉淀是否洗净?________________________________。
(每空2分,共14分)
(1) D ; 1.0×10-20.2
(2)2MnO4―+3Mn2+ + 2H2O = MnO2+ 4H+ ; 26.33
(3)锌粉
(4)3ZnSO4 + 5NH3·H2O + NH4HCO3 = ZnCO3·2Zn(OH)2·H2O↓ + 3 (NH4)2SO4;
向最后一次的洗涤液中滴入1~2滴BaCl2溶液,若无明显的现象,则沉淀已洗净。
题目分析:(1)该流程的目的是制备氧化锌,所以为了不引入新的杂质,需要选择氧化锌 调节溶液的pH值,答案选D;Zn(OH)2完全沉淀时c(Zn2+)=1×10-5mol/L,c(OH-)=1×10-14/1×10-6.4=1×10-7.6mol/L,所以该温度下Zn(OH)2的Ksp= c(OH-)2×c(Zn2+)=1.0×10-20.2
(2)根据流程图可知,加入高锰酸钾后有二氧化锰沉淀出现,所以KMnO4与Mn2+反应生成二氧化锰,离子方程式为2MnO4―+3Mn2+ + 2H2O = MnO2+ 4H+ ;根据得失电子守恒规律,存在MnO4-~3Fe2+,1m3的该溶液中n(Fe2+)=0.5mol,则需要KMnO4的质量为0.5mol/3×158g/mol=26.33g;
(3)杂质Cu2+、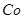 2+可利用置换反应除去,同样是为了不能引入新的杂质,B应是锌粉;
2+可利用置换反应除去,同样是为了不能引入新的杂质,B应是锌粉;
(4)生成ZnCO3·2Zn(OH)2·H2O应是在加入碳酸氢铵与氨水后产生的,溶液中的硫酸锌与之反应生成的沉淀,所以化学方程式为3ZnSO4 + 5NH3·H2O + NH4HCO3 = ZnCO3·2Zn(OH)2·H2O↓ + 3 (NH4)2SO4; 该沉淀中还可能含有硫酸根离子,所以检验洗涤是否干净的方法就是检验硫酸根离子是否存在,具体操作为向最后一次的洗涤液中滴入1~2滴BaCl2溶液,若无明显的现象,则沉淀已洗净。
