(7分)工业上通常用黄铁矿(主要成分FeS2)为原料生产硫酸,先将黄铁矿粉碎,然后按照以下流程制备硫酸:
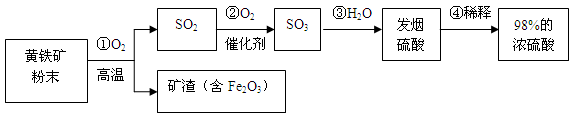
⑴ 先将黄铁矿石粉碎的目的是 。
⑵ 写出稀释浓硫酸的具体操作步骤 。
⑶ 将10g98%的浓硫酸稀释成9.8%的稀硫酸,需要加水 g。
⑷ 取20g矿渣样品(含Fe2O3),向其中加入300g溶质质量分数为9.8%的稀硫酸(已知矿渣中的Fe2O3与稀硫酸恰好完全反应得到Fe2(SO4)3溶液),试通过化学方程式计算该矿渣样品中Fe2O3的质量分数。
⑴ 增大与氧气的接触面积,使之充分应。
⑵ 将浓硫酸沿烧杯内壁慢慢注入浓硫酸中,并用玻璃棒不断搅拌。
⑶ 90g
题目分析:
⑴将黄铁矿石粉碎可增大它与氧气的接触面积,使之充分应。
⑵ 将浓硫酸沿烧杯内壁慢慢注入浓硫酸中,并用玻璃棒不断搅拌。
(3)溶液在稀释前后溶质的质量不变,设稀释后溶液的质量为a,则:
10g×98%=9.8%a
解得a=100g
那么加水的质量=100g-10g=90g
⑷ 利用化学方程式氧化铁与硫酸反应的质量比即可计算出氧化铁的质量。
解:300g9.8%的稀硫酸中含H2SO4的质量是:300g×9.8% = 29.4g
设氧化铁的质量为x
Fe2O3+ 3H2SO4 = Fe2(SO4)3 + 3H2O
160 294
x 29.4g
160:294=x:29.4g
x=16g
16g/20g×100%=80%
答:该矿渣样品中氧化铁的质量分数为80%。
