问题
计算题
(9分)0.2mol有机物A和0.4mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。燃烧后的这些产物经过浓硫酸后,质量增加10.8g;再通过灼热的CuO充分反应后,固体质量减轻3.2g;最后气体再通过碱石灰被完全吸收,质量增加17.6g。
(1)推断该有机物A的分子式。
(2)若0.2mol该有机物A与过量金属钠反应后放出4.48L H2(标准状况下),试确定该有机物的结构简式。
答案
(1)生成物水的物质的量是n(H2O)=10.8g÷18g/mol=0.6mol
CO和氧化铜反应的方程式为
CO+CuO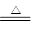 CO2+Cu △m↓
CO2+Cu △m↓
1mol 1mol 16g
0.2mol 0.2mol 3.2g
所以反应中生成的CO2是17.6g÷44g/mol-0.2mol=0.2mol
则有机物A中含有的氧原子的物质的量是0.6mol+0.2mol+0.2mol×2-0.4mol×2=0.4mol
所以A中C、H、O的原子个数之比是0.4︰1.2︰0.4=1︰3︰1
即最简式为CH3O
由于C、H个数之比为1︰3的只能是乙烷
所以A的分子式为C2H6O2
(2)4.48L氢气是0.2mol,说明反应中含有2个羟基
因此结构简式为HOCH2CH2OH
考查有机物分子式及结构简式的判断。
