元素及其化合物知识是化学研究和学习的重要内容。
(1)氯化钠、氯化钙和氯化镁中都含有氯元素,下图是氯在元素周期表中的相关信息,下列说法不正确的是 (填标号)。
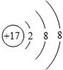

A.该元素属于非金属元素
B.该原子核内质子数为17
C.该元素的原子形成阴离子后,离子结构示意图为
D.该元素的相对原子质量为35.45g根据生活经验,汗水含有的某物质有咸味,构成该物质的微粒是 (填粒子符号)。
碳酸氢钠在焙制糕点和炸油条时常用作发泡剂,用化学方程式解释其原理
(4)现有一包白色粉末,其中含有CuSO4、BaCl2、NaOH、Na2CO3中的一种或几种。某化学小组为确定白色粉末的成分,进行了如下实验:(I)取一定量白色粉末,加入足量水,振荡,得到无色透明溶液;(Ⅱ)取少量(I)的溶液,加入足量盐酸,有气泡产生。(提示:BaCO3难溶于水;Na2CO3的水溶液呈碱性)
①该白色粉末中肯定含有什么物质?可能含有什么物质?
②为确定可能含有的物质是否存在,还需要作进一步的实验验证,请写出简要的实验步骤。
食用纯碱中常含有少量的氯化钠。现取某食用纯碱样品20g,加入一定量稀盐酸恰好完全反应,同时产生了6.6g气体。试计算该食用纯碱中碳酸钠的质量分数。(写出计算过程)。
(1) D (2) Na+、Cl-- (3) 2NaHCO3△Na2CO3 + H2O + CO2↑
(4) ①肯定含有Na2CO3;可能含有NaOH
② 取少量(I)的溶液,加入足量BaCl2溶液(或CaCl2溶液),静置,取上层清液滴加酚酞溶液(或用pH试纸测定pH)
(5)79.5%
题目分析:(1)A、该元素名称的偏旁部首是“气字头”属于非金属元素,正确,B、该原子核内质子数为17,正确,C、该元素的原子做外层电子数为7,所以容易得到1个电子,形成阴离子,正确,D、该元素的相对原子质量为35.45,单位不是g,正确
(2)汗水含有的某物质有咸味,是由于汗液中含有氯化钠,是由离子构成的,构成该物质的微粒是:Na+、Cl--
(3)碳酸氢钠在焙制糕点和炸油条时常用作发泡剂,是因为碳酸氢钠受热易分解,发生的化学方程式是:2NaHCO3△Na2CO3 + H2O + CO2↑
(4)这是一个实验推断题,应紧紧跟住实验的过程,抓住实验过程中的现象进行分析,实验:(I)取一定量白色粉末,加入足量水,振荡,得到无色透明溶液,说明一点不含CuSO4,因为CuSO4的水溶液显蓝色,同时BaCl2和Na2CO3不能共存,因为会形成白色沉淀,而实验中没有这个现象,(Ⅱ)取少量(I)的溶液,加入足量盐酸,有气泡产生,说明一定含Na2CO3,则一定不含BaCl2
①该白色粉末中肯定含有含有Na2CO3;可能含有NaOH
②要确定NaOH是否存在,检验的实验步骤:取少量(I)的溶液,加入足量BaCl2溶液(或CaCl2溶液),静置,取上层清液滴加酚酞溶液(或用pH试纸测定pH),不能直接来检验NaOH是否存在,因为Na2CO3的水溶液也呈碱性
(5)根据反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑中Na2CO3与CO2质量关系,可算出Na2CO3的质量,进而算出食用纯碱中碳酸钠的质量分数
解:设Na2CO3的质量为x
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 44
x 6.6g
106/44="==" x/ 6.6g x="=15.9" g
碳酸钠的质量分数为:15.9 / 20×100%===79.5%
