溴乙烷是一种难溶于水、密度约为水的密度的1.5倍、沸点为38.4℃的无色液体。实验室制取溴乙烷的反应如下:
NaBr+H2SO4(浓) NaHSO4+HBr CH3CH2OH+HBr →CH3CH2Br+H2O
NaHSO4+HBr CH3CH2OH+HBr →CH3CH2Br+H2O
已知反应物的用量:①NaBr(s) 0.3 mol,②浓硫酸36 mL(98%、密度1.84 g•cm–3),
③乙醇0.25 mol,④水25 mL,其中乙醇的密度为水的密度的4/5。
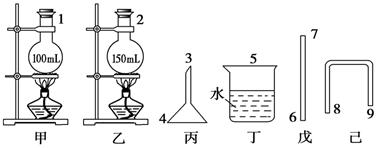
试回答:
(1)仅用如下图所示仪器安装制取和收集溴乙烷的装置,要求达到安全、损失少、不污染环境的目的,有关仪器(相关胶塞上已打合适的孔,胶管未画出。)的选择和连接顺序为 (填数字)。
(2)在实验过程中,考虑到浓硫酸性质的特殊性,试剂加入的合理顺序为________________(请填写试剂的编号);
(3)若试剂加入过快,可看到烧瓶内有红棕色气体产生,写出反应的化学方程式:
。
(4)判定有溴乙烷生成的现象是__________________________。从棕黄色的粗溴乙烷制取无色的溴乙烷,第一步可以加入蒸馏水或NaHSO3溶液,本操作中通常使用的仪器是__________。
(5)本实验的产率为60%,则可制取溴乙烷 g。
(1)连接顺序为 2―9―8―3―4―5(填数字)。
(2)试剂加入的合理顺序为④②③①(请填写试剂的编号);
(3)2NaBr+2H2SO4=∆= Na2SO4+2H2O+SO2 ↑+ Br2↑
(4)丁的烧杯底部有油状液体聚集。 分液漏斗。
(5)16.4
解答本题的关键是使用仪器的选择。
(1)甲、乙是作为溴乙烷的制取装置供选用的,应考虑实验中液体的体积应介于烧瓶容积的1/3到2/3之间为宜。0.25 mol乙醇的体积为0.25×46/0.8,约为14 mL。三种液体混合后,不考虑混合时液体的体积变化。V(总)="36" mL+25 mL+14 mL="75" mL。这一体积超过了甲装置烧瓶容积的2/3,故应选择乙装置。副产物HBr极易溶于水,为有利于蒸气的吸收,并防止倒吸,采用倒置漏斗的方式。故连接顺序为:2―9―8―3―4―5
(2) 考虑到浓硫酸的物理性质及吸水性、脱水性等性,应将硫酸缓慢的加入水中后,再加入其它试剂。
(3)当反应温度过高时,浓H2SO4将部分HBr氧化为红棕色的溴蒸气。
(4)除去溶于溴乙烷中的溴时,应加入稀NaOH溶液振荡洗涤,反应的化学方程式为2NaOH+Br2====NaBr+NaBrO+H2O,之后用分液漏斗分液,除去水层。
(5)n(H2SO4)= 36×1.84×98%/98=0.66 mol
从第一个反应式可以判断生成HBr为0.3 mol,从第二个反应式判断HBr过量,所以CH3CH2Br理论产量为0.25 mol×109 g·mol-1=27.25 g,实际产量为:27.25 g×60%=16.4g。
