问题
选择题
下列反应的离子方程式正确的是 ( )
A.乙酸乙酯与氢氧化钠溶液反应:CH3COOCH2CH3+OH-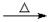 CH3COO- +CH3CH2O- +H2O
CH3COO- +CH3CH2O- +H2O
B.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-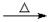 CH2BrCOO-+H2O
CH2BrCOO-+H2O
C.苯酚钠溶液中通入少量二氧化碳:CO2 + H2O + 2C6H5O- 2C6H5OH + 2CO32-
2C6H5OH + 2CO32-
D.乙醛溶液与新制氢氧化铜碱性悬浊液共热CH3CHO+2Cu(OH)2+OH--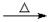 CH3COO-+ Cu2O↓+ 3H2
CH3COO-+ Cu2O↓+ 3H2
答案
答案:D
题目分析:A.乙酸乙酯与氢氧化钠溶液反应产生CH3COONa、乙醇CH3CH2OH,错误;B.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热,反应产生CH2(OH)COONa。错误;C.苯酚钠溶液中通入少量二氧化碳产生NaHCO3,错误。D。反应符合客观事实,正确。
