在H2SO4、K2SO4、Al2 (SO4)3和明矾[KAl(SO4)2·12H2O]的混合溶液中,H+的浓度为0.2mol/L,SO42-的浓度为0.5mol/L,当加入等体积0.6mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
A.0.225mol/L
B.0.25mol/L
C.0.45mol/L
D.0.55mol/L
答案:D
题目分析:在H2SO4、Al2(SO4)3、K2SO4和明矾的混和溶液中,加入等体积的0.6mol/L的KOH溶液时,H+优先反应,0.2mol/L的H+消耗0.2mol/L的OH-,则与Al3+反应的OH-的浓度为:0.6mol/L-0.2mol/L=0.4mol/L;生成的沉淀恰好溶解,发生反应Al3++4OH-=AlO2-+2H2O,可知原溶液中c(Al3+)=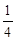 ×0.4mol/L=0.1mol/L,根据电荷守恒可知,原溶液中:c(H+)+c(K+)+3c(Al3+)=2c(SO42-),即c(K+)=2c(SO42-)-3c(Al3+)-c(H+)=2×0.5mol/L-0.1mol/L×3-0.2mol/L=0.5mol/L;设溶液体积为V,反应前后K+的物质的量不变,则反应后溶液中K+的浓度约为
×0.4mol/L=0.1mol/L,根据电荷守恒可知,原溶液中:c(H+)+c(K+)+3c(Al3+)=2c(SO42-),即c(K+)=2c(SO42-)-3c(Al3+)-c(H+)=2×0.5mol/L-0.1mol/L×3-0.2mol/L=0.5mol/L;设溶液体积为V,反应前后K+的物质的量不变,则反应后溶液中K+的浓度约为 =0.55mol/L,故选D。
=0.55mol/L,故选D。