某校化学兴趣小组的同学利用下列装置进行实验.
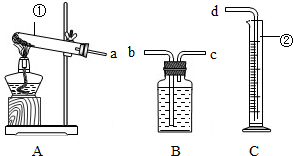
实验目的:(1)用高锰酸钾制取一瓶氧气,做细铁丝燃烧的实验.
(2)粗略测定加热2g高锰酸钾所收集到的氧气体积.
反应原理:(用化学方程式表示)
高锰酸钾制氧气:______;
细铁丝在氧气中燃烧:______.
仪器认识:写出仪器①②的名称:①______;②______.
装置连接:为达到实验目的(2),各装置的正确连接顺序是:(填接口的字母)a→______→d
问题分析:(1)实验过程发现B瓶中的水变红了,原因是:______;
(2)用收集到的氧气做细铁丝燃烧的实验时,发现瓶底炸裂,发生失误的操作原因可能是:______.
(3)根据化学方程式可算出理论上2g高锰酸钾完全分解可生成氧气0.203g.而实际测得氧气在标准状况下的体积为177mL,换算成质量为0.253g,超过理论量为:0.253g一0.203g=0.05g.从理论上推测,你认为超过理论量的氧气可能来源于什么物质?______.(写出所有可能,空气、水因素忽略不计)
反应原理:依据反应物、生成物及质量守恒定律书写方程式如下:2KMnO4
K2MnO4+MnO2+O2↑;3Fe+2O2 △ .
Fe3O4; 点燃 .
仪器认识:了解常用仪器的名称和应用,可知①试管,②量筒;
装置连接:为达到实验目的粗略测定加热2g高锰酸钾所收集到的氧气体积,首先用A装置制取氧气,B装置收集气体,为了便于水的排出用来测量生成氧气体积,从c进d出,各装置的正确连接顺序是a→c→b→d;
问题分析:(1)用高锰酸钾制取一瓶氧气,试管口要放一团棉花,防止加热时高锰酸钾粉末进入导管,进而进入瓶中,因此,实验过程中发现B瓶中水变红了,原因是试管口没有放一团棉花或高锰酸钾粉末进入瓶中;
(2)用收集到的氧气做细铁丝燃烧的实验时,瓶底要预先放一些水,防止燃烧后的熔融物溅落瓶底,引起瓶底炸裂;
(3)C中水的体积即为收集的氧气的体积,制得氧气的实际量高于理论量,超出的氧气不会凭空产生,因为题中提示除去可能混有空气、水因素外,依据质量守恒定律化学反应前后元素的种类不变,只可能来源于含有氧元素的是K2MnO4、MnO2.
故答案为:
2KMnO4
K2MnO4+MnO2+O2↑;3Fe+2O2 △ .
Fe3O4; 点燃 .
①试管②量筒;c、b;
(1)试管口没有放一团棉花或高锰酸钾粉末进入瓶中;
(2)瓶中没有留少量水;
(3)K2MnO4、MnO2
