请按要求回答下列问题:
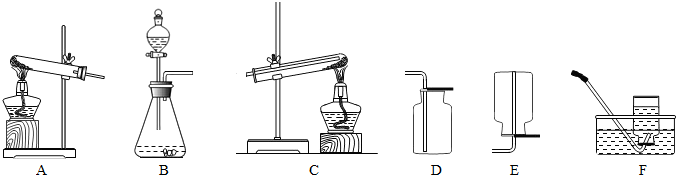
(1)根据下表的实验内容,从上图中选择合适的装置,填入表中.
| 实验内容 | 选用的仪器装置(填字母) |
| 制取和收集氧气 | ______ |
| 制取和收集氢气 | ______ |
| 氢气还原氧化铜 | ______ |
| 制取和收集二氧化碳 | ______ |
某同学在实验室中,欲从高锰酸钾受热分解后的残渣中回收二氧化锰(已知高锰酸钾、锰酸钾溶于水,二氧化锰难溶水),正确的实验操作是______(填序号).
①溶解、蒸发、结晶 ②溶解、过滤 ③过滤、蒸发、结晶
(3)在氢气还原氧化铜的实验过程中,观察到的现象是______.
(4)若取质量均为m g的镁和铁,分别投入到50g溶质质量分数相同的硫酸中,充分反应后,均产生0.2g氢气.可推断出:
①充分反应后,一定有剩余的金属是______.
②m的取值范围为______,反应中消耗掉金属镁的质量为______.
③硫酸中的H2SO4的质量分数为______.
(1)实验室制氧气方法为加热高锰酸钾固体,氧气不易溶于水,密度大于空气密度;实验室制氢气药品为金属锌与稀硫酸,氢气难溶于水,密度小于空气密度;实验室制二氧化碳药品为石灰石和稀盐酸,二氧化碳能溶于水,密度大于空气密度;
(2)在实验室中,加热氯酸钾和二氧化锰的混合物制取氧气的反应原理为2KClO3
2KCl+3O2↑;锰酸钾溶于水,二氧化锰不溶于水,可用溶解、过滤的方法提纯二氧化锰;MnO2 . △
(3)氢气还原氧化铜的装置是C装置,反应的现象为试管中黑色粉末逐渐变为光亮的红色,同时管口有水滴生成;
(4)产生0.2g氢气时消耗镁的质量为2.4g,消耗铁的质量为5.6g,因此剩余的金属一定是镁,m的值一定不小于5.6g;产生0.2g,消耗硫酸的质量为9.8g,所以所用硫酸溶液中溶质的质量分数为19.6%.
故答案为
(1)AF(或AD);BF(或BE);C;BD
(2)2KClO3
2KCl+3O2↑;②MnO2 . △
(3)试管中黑色粉末逐渐变为光亮的红色,同时管口有水滴生成
(4)①镁;②m≥5.6;2.4g③19.6%
