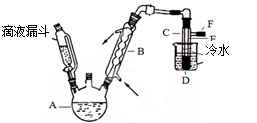
下图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置。有关数据见表3:
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色 液体 | 无色 液体 | 深红棕色 液体 |
| 密度/g·cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
表3.乙醇、溴乙烷、溴有关参数
(1)制备操作中,加入的浓硫酸必需进行稀释,其目的是 (选填序号)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(2)写出溴化氢与浓硫酸加热时发生反应的化学方程式 。
(3)图中试管C中的导管E的末端须在水面以下,其原因是 。
(4)加热的目的是 。
(5)为除去产品中的一种主要杂质,最好选择下列 (选填序号)溶液来洗涤产品。
A.氢氧化钠 B.碘化亚铁 C.亚硫酸钠 D.碳酸氢钠
(6)第(5)步的实验所需要的玻璃仪器有 。
B.[实验化学]
(1)a、b、c(2分)
(2)2HBr+H2SO4(浓) SO2+Br2+2H2O(2分)
SO2+Br2+2H2O(2分)
(3)增加获得溴乙烷的质量(或减少溴乙烷的挥发)(2分)
(4)加快反应速率,蒸馏出溴乙烷(2分)
(5)C(2分)
(6)分液漏斗、烧杯(2分)
题目分析:(1)乙醇与浓硫酸和溴化钠混合在一起,会发生乙醇的消去反应生成乙烯,乙醇分子间脱水生成醚,同时溴化钠会被浓硫酸氧化生成溴单质,由于浓硫酸具有吸水性当然也会使生成的HBr容易挥发出来等。因此在制备时要将浓硫酸进行适当稀释。
(2)运用氧化还原原理来书写:2HBr+H2SO4(浓) SO2+Br2+2H2O(2分)
SO2+Br2+2H2O(2分)
(3)由于溴乙烷常温下是液体但其沸点仍是比较低的,易挥发通过用水冷却可增加获得溴乙烷的质量(或减少溴乙烷的挥发)。
(4)通过加热可加快反应速率同时有利于蒸馏出溴乙烷。
(5)产品中溶解了未反应的溴单质,选择氢氧化钠也会使溴乙烷损失,选择碘化亚铁同时又生成了碘杂质仍会溶解中其中,选择碳酸氢钠会有大量气泡关系会引发溴乙烷的挥发,最好选择亚硫酸钠,通过发生氧化还原反应生成了硫酸钠和溴化钠再通过分液较好分离。
(6)由第(5)的分析,最后要进行分液操作,所以用到的玻璃仪器有分液漏斗、烧杯
