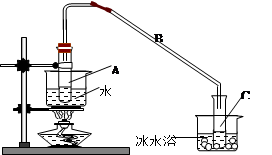
某化学小组采用类似制乙酸乙酯的装置(如下图),以环己醇制备环己烯
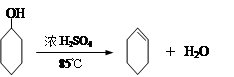
| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热 至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是 。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
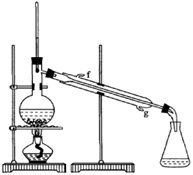
②再将环己烯按下图装置蒸馏,冷却水从_________口进入。蒸馏时要加入生石灰,目的是_____________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是( )
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
A.用酸性高锰酸钾溶液 B.用金属钠 C.测定沸点
(1)①防暴沸 冷凝 ②防止环己烯挥发
(2)①上层 C ②g 除水 ③83oC C (3)BC
题目分析:(1)由于生成的环己烯的沸点为83℃,要得到液态环己烯,导管B除了导气外还具有冷凝作用,便于环己烯冷凝;由于环己烯沸点低,易挥发,所以冰水浴的目的降低温度,防止环己烯的挥发。
(2)①环己烯的密度小于水的,不溶于水,所以在上层;由于分液后环己烯粗品中还含有少量的酸和环己醇,联想制备乙酸乙酯提纯产物时用饱和Na2CO3溶液洗涤可除去酸和醇,所以选择的水碳酸钠溶液。不能用酸性高锰酸钾,否则会氧化环己烯,答案选C。生石灰具有吸水性,所以蒸馏时要加入生石灰的目的是除去水分。
②冷却水的流向和气体的流向是相反的,因此冷却水从g口进入,f口出来。
③收集时,只要液体温度达到环己烯的沸点,能把其蒸馏出来就可以了,温度太低蒸馏不出。温度太高,易导致反应温度过高而碳化。因此根据环己烯的沸点可知,一般控制在83℃左右;,实验制得的环己烯精品质量低于理论产量,这说明反应物的转化率低,因此可能的原因是制备粗品时环己醇随产品一起蒸出,答案选C。
(3)区别粗品与精品可加入金属钠,观察是否有气体产生,若无气体,则是精品,混合物没有固定的沸点,而纯净物有固定的沸点,通过测定环己烯粗品和环己烯精品的沸点,可判断产品的纯度,因此答案选BC。
点评:本题以有机合成为载体综合考查了实验室制环己烯的知识和醇、烃的性质,考查了学生综合运用实验的能力,属于中等难度的试题。答题时注意把握实验原理和方法,特别是实验的基本操作,学习中注意积累。
